Инсулином называется гормон, производимый бета-клетками островков Лангерганса поджелудочной железы. Название инсулина происходит от латинского insula – остров. Эффекты инсулина
Несмотря на то, что инсулин вызывает множество эффектов в различных тканях человеческого тела, его основным эффектом является стимулирование перехода глюкозы из крови внутрь клеток, что приводит к снижению концентрации глюкозы в крови.
Другими эффектами инсулина являются стимулирование синтеза в печены и мышцах гликогена из глюкозы, увеличение создания жиров и белков, подавление активности ферментов, разрушающих жиры и белки. Таким образом, инсулин обладает анаболическим действием, поскольку усиливает образование жиров и белков, одновременно замедляя их распад.
Основной эффект инсулина заключается в усилении переноса глюкозы через клеточную мембрану внутрь клетки. Других гормонов, снижающих уровень глюкозы крови, в организме человека не существует. Основные эффекты инсулина проявляются в мышцах и жировой ткани, поэтому эти ткани называют инсулинозависимыми. Уровень глюкозы крови снижается при воздействии инсулина и повышается при воздействии т.н. гипергликемических гормонов (глюкагона, соматотропного гормона, глюкокортикоидов).
Дополнительными эффектами инсулина являются увеличение интенсивности образования гликогена, уменьшение образования глюкозы в печени, усиление поглощения клетками аминокислот, необходимых для синтеза белка. Одновременно инсулин уменьшает разрушение белков и жиров. Таким образом, общий эффект инсулина является анаболическим – направленным на формирование жировой и мышечной ткани.
Гормональная деятельность островков Лангерганса
Незначительный размер островковых скоплений, а также небольшая площадь, которую они занимают в ПЖ, ˗ это неоспоримый факт. Однако значение этой структуры для всего организма в целом очень велико, ведь именно в неё образуются гормоны, которые принимают участие в обменном процессе. Сюда относится не только инсулин, но и соматостатин, глюкагон, полипептид ПЖ. Рассмотрим их основное предназначение.
- Инсулин необходим для регулирования углеводного баланса, поддержки адекватного уровня глюкозы в крови, транспортировки калия, жиров, глюкозы и аминокислот в клетки. Кроме того, этот гормон участвует в образовании гликогена, он влияет на синтез жиров и белков, а также повышает проницаемость плазматической мембраны.
- Целый перечень функций имеется у гормона глюкагона, который:
- Способствует расщеплению гликогена, за счёт чего происходит выброс глюкозы;
- Запускает расщепление липидов: когда в жировых клетках увеличивается уровень липазы, в кровь начинают поступать продукты распада липидов, выступающие источниками энергии;
- Обеспечивает быстрое выведение из организма натрия, тем самым улучшая работу сосудов и сердца;
- Повышает концентрацию кальция внутри клеток;
- Улучшает приток крови к почкам;
- Активизирует образование глюкозы из тех веществ, которые не являются составляющими углеводной группы;
- Повышает АД;
- Способствует восстановлению печёночных клеток;
- Оказывает спазмолитическое действие при своих особенно высоких концентрациях.
- Гормон дельта-клеток соматостатин контролирует продуцирование пищеварительных ферментов, а также других гормонов. Благодаря его воздействию происходит снижение выработки инсулина и глюкагона.
- Панкреатический полипептид ˗ его продуцируют РР-клетки, и несмотря на то, что их в островковых скоплениях очень мало, значение данного вещества очень важно: полипептид принимает активное участие в контролировании секреции желудка и печени. Известно, что при недостаточном количестве этого гормона развиваются различные патологические процессы.
Каким образом устроены островки и в чём их предназначение
Основная задача островков Лангерганса заключается в поддержании углеводного баланса, а также в осуществлении контроля над деятельностью всех эндокринных органов. Эти скопления очень хорошо снабжаются кровью, а их иннервация происходит за счёт блуждающих и симпатических нервов.
Структура островков довольно сложная, их клетки располагаются в хаотичном порядке по типу мозаики. Каждое из скоплений представляет собой самостоятельное совершенное образование, состоящее из долек, окружённых соединительными тканями и имеющее внутри клеток проходящие кровеносные капилляры. Бета-клетки располагаются в центре скоплений, альфа- и дельта-клетки составляют периферию. Взаимодействуя друг с другом, клетки запускают механизм обратной связи, характеризующийся влиянием одних клеток на другие, расположенные рядом:
- Альфа-клетки производят глюкагон, который, в свою очередь, оказывает определённое воздействие на d-клетки;
- Соматостатин, вырабатываемый d-клетками, угнетает деятельность альфа- и бета-клеток;
- Подавляет альфа-клетки и инсулин, однако одновременно с этим, он активизирует бета-клетки.
Когда в деятельности иммунной системы происходит какой-либо сбой, возникают особые иммунные тела, приводящие к дисфункции работы бета-клеток, в результате чего развивается такая патология, как сахарный диабет (СД).
Немного анатомии
В ткани поджелудочной железы находятся не только ацинусы, но и островки Лангерганса. Клетки этих образований не продуцируют ферменты. Их основная функция – вырабатывать гормоны.
Эти эндокринные клетки впервые обнаружены в 19 веке. Ученый, в честь которого названы эти образования, тогда был еще студентом.
В самой железе островков не так уж и много. Среди всей массы органа зоны Лангерганса составляют 1-2%. Однако, роль их велика. Клетки эндокринной части железы продуцируют 5 типов гормонов, которые регулируют пищеварение, углеводный обмен, ответ на стресс реакции. При патологии этих активных зон развивается одно из распространенных болезней 21 века – сахарный диабет. Кроме того, патология этих клеток вызывает синдром Золлингера-Эллисона, инсулиному, глюкоганому и другие редкие заболевания.
На сегодняшний день известно, что островки поджелудочной железы имеют 5 типов клеток. Подробнее поговорим об их функции ниже.
Альфа-клетки
Эти клетки составляют 15-20% от количества всех ячеек островков. Известно, что у человека больше альфа-клеток, чем у животных. Эти зоны выделяют гормоны, отвечающие за реакцию «бей и беги». Глюкагон, который образуется здесь, резко повышает уровень глюкозы, усиливает работу скелетных мышц, ускоряет работу сердца. Также глюкагон стимулирует выработку адреналина.
Глюкагон рассчитан на короткий срок воздействия. Он быстро разрушается в крови. Вторая значимая функция этого вещества – антагонизм инсулину. Глюкагон выделяется при резком снижении глюкозы в крови. Такие гормоны вводятся в стационарах пациентам с гипогликемическими состояниями и коме.
Бета-клетки
Эти зоны паренхиматозной ткани выделяют инсулин. Они самые многочисленные (около 80% клеток). Их можно встретить не только в островках, единичные зоны секреции инсулина есть в ацинусах и протоках.
Функция инсулина в снижении концентрации глюкозы. Гормоны делают мембраны клеток проницаемыми. Благодаря этому молекула сахара быстро попадает внутрь. Далее, они активируют цепь реакций выработки из глюкозы энергии (гликолиз) и отложении ее про запас (в виде гликогена), образования из нее жиров и белков. Если инсулин не выделяется клетками – развивается сахарный диабет 1 типа. Если гормон не действует на ткань – формируется сахарный диабет 2 типа.
Выработка инсулина – это сложный процесс. Его уровень могут повысить углеводы, поступившие с пищей, аминокислоты (особенно лейцин и аргинин). Инсулин повышается при увеличении кальция, калия и некоторых гормонально активных веществ (АКТГ, эстроген и другие).
В бета зонах также образуется С-пептид. Что это такое? Этим словом называют один из метаболитов, который образуется при синтезе инсулина
В последнее время у этой молекулы появилось важное клиническое значение. При образовании молекулы инсулина образуется одна молекула С-пептида
Но последний обладает более длительным сроком распада в организме (инсулин проживает не более 4 минут, а С-пептид около 20). С-пептид снижается при сахарном диабете 1 типа (изначально вырабатывается мало инсулина), а повышается при втором типе (инсулина много, а ткани на него не реагируют), инсулиноме.
Дельта-клетки
Это зоны поджелудочной ткани клеток Лангерганса, которые секретируют соматостатин. Гормон тормозит активность выделения ферментов. Также вещество замедляет другие органы эндокринной системы (гипоталамус и гипофиз). В клинике применяется синтетический аналог или Сандостатин. Препарат активно вводится при приступах панкреатита, операциях на панкреас.
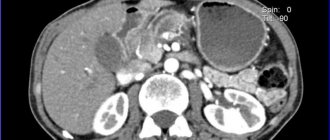
Сахарный диабет 1-го типа (СД1) — хроническое заболевание, поражающее генетически предрасположенных лиц, у которых инсулинсекретирующие β-клетки островков Лангерганса (ОЛ) поджелудочной железы (ПЖ) избирательно и необратимо разрушены в результате аутоиммунной атаки организма [1—4]. По данным Международной федерации диабета, в мире СД1 страдают более 36 млн человек, в США — 1,4 млн человек [5, 6]. В динамике 2013—2016 гг. сохраняется рост распространенности СД. В РФ по состоянию на 31.12.16 распространенность СД1 составила 164,19 случая на 100 тыс. населения, или 6% общего числа больных (255 тыс. из 4348 млн) [7]. Хотя внедрение инсулинотерапии привело к значительному увеличению продолжительности жизни пациентов с СД1, такие хронические осложнения, как потеря зрения и почечная недостаточность, продолжают снижать качество жизни больных и ежегодно требуют многомиллиардных расходов в системе здравоохранения [8, 9].
Поддержание уровня глюкозы крови в пределах определенных показателей считается наиболее эффективным подходом для предупреждения манифестации и замедления прогрессирования хронических осложнений СД1 [10]. В настоящее время эта задача может решаться усиленной терапией с многократными инъекциями инсулина, требующего точного мониторинга уровня глюкозы крови [11]. При этом по своей эффективности подкожное введение инсулина никогда не сможет приблизиться к его волнообразной секреции нормально функционирующими β-клетками и редко обеспечивает нормальные уровни глюкозы крови без риска возникновения эпизодов выраженной гипогликемии [12]. Кроме того, интенсивная инсулинотерапия подходит только для определенной группы пациентов [13].
Пересадка ПЖ является альтернативным методом лечения, которое может предотвратить развитие осложнений СД без увеличения риска возникновения эпизодов гипогликемии [14]. Трансплантация П.Ж. началась в 70-х гг. и быстро была внедрена в клиническую практику. За последние 40 лет методика постоянно совершенствовалась, приводя к благополучным исходам [15]. Показатель снижения зависимости от инсулина при одномоментной трансплантации почки и ПЖ увеличился с 77% в период с 1987 по 1993 г. до 91,3% за 2010—2014 гг. [16].
Хотя эта методика обеспечивает более высокий показатель снижения зависимости от инсулина, она тем не менее имеет более осложненное течение послеоперационного периода и требует более жесткого режима иммуносупрессивной терапии (ИСТ) [17]. Кроме того, при отторжении трансплантата ПЖ требуется незамедлительное удаление пересаженной ткани, что приводит к моментальной и полной потере функции трансплантата. К сожалению, данная операция, обычно выполняемая одномоментно с пересадкой почки, сопровождается высокой частотой как осложнений, так и летальности [18]. Несмотря на значительное улучшение качества жизни больных, пересадка ПЖ, как правило, показана только узкому кругу пациентов [19].
В связи с этим трансплантация ОЛ представляет альтернативное решение проблемы, нормализуя метаболизм глюкозы без риска выраженной гипогликемии и устраняя потенциально опасные для жизни осложнения после пересадки ПЖ единым органом [20]. Возможно, оценка результатов двух данных операций по показателю снижения зависимости от инсулина является слишком ограниченной, поскольку у каждой есть много особенностей. Безусловно, для обогащения доказательной базы необходимы проспективные рандомизированные контролируемые исследования, сравнивающие оба метода [21].
Краткая история и основные этапы развития трансплантации островков Лангерганса
Первыми инсулинотерапию применили F. Banting и C. Best [22] в 1922 г. и коренным образом изменили лечение пациентов с С.Д. Методика продлила жизнь миллионам больным. Однако инсулинотерапия лечит, но не вылечивает пациентов. К сожалению, она не предотвращает развитие вторичных осложнений, связанных с длительным течением заболевания. Потребность в более стойкой ремиссии вдохновляла исследователей на поиски других вариантов.
В 1967 г. Р. Lacy и М. Kostianovsky [23] сообщили о том, что можно получать жизнеспособные клетки островков ПЖ у крыс-доноров. Их эксперименты доказали, что введение ОЛ через воротную вену крысам-реципиентам с СД помогает достигнуть стабильной нормогликемии. Опыт лег в основу создания методики выделения ОЛ и определения органа для трансплантации. Последующие достижения в области ферментативного расщепления и очищения ткани ПЖ повысили частоту успешных заборов ОЛ у человека [24]. Внутрипротоковое введение коллагеназы стало эффективным способом получения островков у крупных животных и человека. Первая клиническая пересадка островковых клеток была выполнена в Университете Миннесоты, США [25]. В России аллотрансплантация культур клеток ОЛ впервые была проведена в 1979 г. в Научно-исследовательском институте трансплантологии и искусственных органов (НИИТиИО). В качестве источника получения ОЛ была выбрана ПЖ 16—22-недельных плодов человека [26].
Из-за трудностей получения достаточного количества человеческих клеток ОЛ первые пересадки редко были успешными. Так продолжалось до тех пор, пока С. Ricordi [27] не представил новый метод выделения клеток ОЛ у человека. Этот способ позволил исследователям получать на системной основе большое количество очищенных и жизнеспособных островков для пересадки. Попытки пересадить клетки ОЛ больным, страдающим СД, заканчивались неудачей, за исключением случаев, описанных в начале 90-х гг. в Питсбурге, США. Это была первая успешная серия аллотрансплантаций. Она подтвердила концепцию; во всем мире только 8% из всех страдающих СД реципиентов смогли обходиться без введения экзогенного инсулина [28].
Показания
Пересадка клеток ОЛ может быть выполнена сама по себе или после пересадки почки [29, 30]. Основными показаниями к изолированной трансплантации клеток ОЛ является СД1, осложненный нечувствительностью к развитию гипогликемии, тяжелыми гипогликемическими приступами и/или гликемической лабильностью, несмотря на попытки купирования путем интенсивной терапии инсулином при соответствующем мониторинге [31]. У детей важно избегать рисков ИСТ и учитывать критерии продолжительности СД1 более 5 лет и возраст старше 18 лет [32].
Однако если есть угроза для жизни пациента или возможно необратимое повреждение головного мозга из-за тяжелых неконтролируемых гипогликемических приступов, которые невозможно предотвратить иными методами, рассматривают расширение показаний к трансплантации [33]. Пересадку клеток ОЛ не следует выполнять пациентам с резистентностью к инсулину или требующим очень высоких доз инсулина и особенно больным с индексом массы тела (ИМТ) более 30 кг/м2 и/или массой тела более 90 кг, и/или с ежедневным введением инсулина в дозе, превышающей 1 ЕД/кг [34].
Критерии отбора для пересадки клеток ОЛ после пересадки почки являются более мягкими, чем для изолированной трансплантации клеток ОЛ, поскольку в первом случае больные уже получают постоянную ИСТ после трансплантации почки [35]. Однако прежде чем отбирать больных, следует оценить функцию пересаженной почки [36]. Больные не должны быть носителями полиомавирусов (BKV), это исключит дополнительные риски, поскольку в результате ИСТ с угнетением Т-лимфоцитов возрастает риск развития ассоциированной с BK-вирусом нефропатии. Этот вирус является оппортунистической инфекцией, которая обостряется в условиях ИСТ, вызывает ВК-вирусную нефропатию и отторжение пересаженной почки [37].
Важно иметь отрицательную перекрестную пробу на гистосовместимость для долгосрочной функции пересаженных клеток ОЛ [38]. Риск общей сенсибилизации по главному комплексу гистосовместимости существует после проведенных гемотрансфузий или ранее выполненной трансплантации почки [39, 40].
Получение клеток островков Лангерганса и трансплантация
Для успешного получения клеток ОЛ и долгосрочного функционирования трансплантата важно подобрать подходящего донора [41]. В идеале он должен подходить для пересадки как ПЖ, так и ее клеток [33]. Однако в отличие от пересадки органа, когда большой риск осложнений связан с высокими показателями ИМТ донора, при клеточной трансплантации люди с высоким ИМТ могут быть донорами [42]. Более того, более высокий ИМТ коррелирует с успешным забором клеток ОЛ при условии возраста донора от 20 до 50 лет и нормальных уровней глюкозы крови на момент выделения клеточной культуры. Получение клеток от доноров моложе 50 лет с ИМТ>27 кг/м2 фактически возможно и является ключевым фактором для достижения хорошего результата [43]. При рассмотрении доноров с ИМТ>30 кг/м2 лица с уровнем гликированного гемоглобина (HbA1с) более 6,5% не должны быть отобраны по причинам риска скрытого СД2 и связанных с ним недиагностированных нарушений секреции инсулина [44].
Восстановление ПЖ при трансплантации клеток ОЛ аналогично таковому при пересадке органа [45]. Однако при выделении трансплантата не требуется сохранять кровеносные сосуды, поскольку хирургические реконструкции не будут нужны. Для того чтобы получить функционально полноценные и в достаточном количестве донорские островки, манипуляции с ПЖ должны проводиться максимально бережно и внимательно, чтобы не повредить капсулу, минимизировать время процедуры и максимизировать оксигенированный кровоток в ПЖ перед пережатием аорты [46]. После пережатия аорты и забора остальных органов для трансплантации ПЖ должна быть удалена единым блоком с участком двенадцатиперстной кишки, прилежащим к ее головке, и помещена в тройной пакет с охлажденным раствором консерванта («University of Wisconsin» или альтернативный раствор) при температуре 4 °C для транспортировки в стерильных условиях в лабораторию, где получают клетки ОЛ [47, 48].
Поскольку ПЖ очень чувствительна к травматизации и неспецифической активации эндогенных протеолитических ферментов, лучше выделять ее в первую очередь, до забора остальных органов брюшной полости, чтобы минимизировать время ишемии и возможное повреждение ткани. Полный цикл получения и очистки клеток ОЛ представляет собой 4—6 ч многоступенчатого извлечения сотен тысяч клеточных кластеров, составляющих лишь 1—2% общей массы ткани органа. Воздействие протеолитическими ферментами в сочетании с мягким механическим сепарированием, очисткой и помещением в культуру входят в установленную процедуру подготовки клеток ОЛ к трансплантации в виде гранул размером менее 5 см3 для внутрипортального введения [49].
Процесс выделения клеток ОЛ претерпел изменения в течение последних сорока лет. Однако автоматизированная методика Ricordi [50] остается ключевой технологией, принятой во многих странах мира. Ее основные этапы включают обработку ПЖ в замкнутом контуре при помощи ферментативного процесса, следующего за внутрипротоковым введением ферментов (коллагеназы I и II типов), и механического разобщения с очисткой центрифугированием [51, 52].
Стандартизованные инструкции и сводный протокол серийного производства детально описывают каждый этап процедуры: от выбора донора, получения и очистки клеточной культуры до предтрансплантационного культивирования in vitro
, контроля качества и критериев выпуска готового продукта для трансплантации (определение идентичности, жизнеспособности, силы действия и стерильности готового продукта клеток ОЛ). Все эти показатели подлежат регистрации. В настоящее время наиболее эффективные клинические лаборатории по получению клеток могут подготовить более 50% обработанных органов для последующей трансплантации, а максимальная эффективность составляет 89,5%. Для удовлетворительного метаболического эффекта после пересадки минимально рекомендуемое число β-клеток должно превысить 5000. Однако при получении культуры от единственного донора инсулиннезависимость при введении в систему воротной вены достигается при наличии более 7000 IEQ/кг (единиц эквивалента ОЛ на 1 кг массы тела).
После получения клеток ОЛ их помещают в питательную среду и инкубируют в течение 24—72 ч, чтобы провести необходимый контроль качества, а также начать ИСТ пациенту перед трансплантацией. Данный порядок зависит от конкретного медицинского учреждения, в некоторых центрах трансплантации пересадку предпочитают проводить немедленно. Ряд исследователей [53] полагают, что период культивирования приводит к лучшей очистке препарата, количество отмерших или вошедших в апоптоз клеток становится минимальным. Кроме того, побочные продукты и цитокины могут запускать и увеличивать воспаление после трансплантации [54, 55].
Подготовленную клеточную массу помещают в среду для пересадки и переносят в стерильную систему для инфузии с гепарином из расчета 70 ЕД/кг массы тела реципиента. Инфузия раствора производится под действием силы тяжести или при помощи введения в чрескожно установленный катетер в систему портальной вены. Создается доступ к воротной вене под УЗ- и рентгеноконтролем, что делает пересадку клеток ОЛ одной из самых безопасных трансплантологических процедур [56]. В опытных руках риск кровотечения практически исключен, несмотря на антикоагулянтную терапию гепарином, нацеленную на предотвращение тромбоза воротной вены. После инфузии катетер из печени удаляют и применяют местные гемостатические средства (DSTAT или Avitene), чтобы исключить кровотечение [57]. Применение данных паст на область минимум до 4 см значительно снижает риск кровотечения после внутрипортального введения ОЛ в сочетании с гепарином. После процедуры системную терапию гепарином продолжают из расчета 3 ЕД/кг/ч до тех пор, пока активированное частичное тромбопластиновое время не составит 60—80 с. Как правило, введение гепарина продолжают в течение 48 ч с целью снизить активацию немедленного выброса провоспалительных цитокинов: гепарином (эноксапарин 30 мг подкожно 2 раза в сутки, в течение 7 сут) и далее переходят на пероральный прием аспирина 81 мг в течение 14 сут.
Уровень HbA1c и функцию печени после трансплантации пристально контролируют. В дальнейшем состояние воротной вены необходимо оценивать УЗ-методом таким образом, как это принято в конкретной клинике. Обычно УЗИ делают на следующий день после трансплантации и далее на 3-и и 5-е сутки в динамике. При невозможности чрескожного доступа делают мини-лапаротомный доступ для внутривенного введения клеток после зондирования ветвей воротной вены (сальниковой или брыжеечной вен).
Несмотря на то что эксперты по клинической трансплантации клеток ОЛ считают воротную вену лучшим или наиболее подходящим местом введения трансплантата, в перитрансплантатном периоде происходит значительная ранняя потеря жизнеспособных клеток из-за низкого парциального давления кислорода, выброса медиаторов воспаления и провоспалительных цитокинов [58]. При существующем уровне развития клинической трансплантации клеток ОЛ необязательно печень может считаться лучшим местом для их пересадки [59]. Во-первых, орган недоступен для безопасной биопсии пересаженной ткани и ее удаление невозможно [60]. Во-вторых, в печени нет оптимальных условий для приживления трансплантата из-за высокого уровня медиаторов воспаления в системе портальной циркуляции и эффекта немедленного выброса провоспалительных цитокинов [61].
Однако пока альтернативное и превосходящее по своим характеристикам печень место введения для трансплантации клеток ОЛ не найдено. Исход пересадки главным образом зависит от количества жизнеспособных и функциональных клеток, поэтому исследователи сосредоточены на поиске дополнительных органов, которые могут быть пригодны для трансплантации. Помимо воротной вены, клетки экспериментально пересаживали под капсулу почки, в селезенку, ПЖ, брюшину, сальник, кишечную стенку, яички, тимус, костный мозг, переднюю камеру глаза и межмышечные пространства [62—65]. Несмотря на определенные успехи подобных исследований, пересадка в систему воротной вены является клинически оправданной. В связи с тем, что успех трансплантации клеток ОЛ в основном зависит от количества жизнеспособных и функциональных клеток, которые сохраняются в перитрансплантатном периоде, исследователи работают над поиском альтернативных локализаций, подходящих для пересадки. Клетки, пересаженные в сальник, дали начало хорошо васкуляризированным инсулинпродуцирующим островкам. По сравнению с воротной веной островки, пересаженные в сальник, показали более отсроченное приживление трансплантата, достигая в конечном счете аналогичных уровней продукции C-пептида. Не так давно с успехом был выполнен малоинвазивный лапароскопический доступ введения клеток ОЛ в сальниковую сумку с иммобилизацией коагулированной сывороткой у одного пациента. Группа исследователей использовали участок костного мозга для трансплантации [66]. Внешнее, окисгенирующее устройство для инфузии также показало многообещающий результат у единственного пациента, и сейчас апробируется имплантируемый под кожу вариант приспособления [67]. Привлекательной также считается межмышечная локализация из-за легкого доступа и хорошо оксигенированной окружающей среды. При пересадке эндоскопическим способом у свиней использовали подслизистый слой стенки желудка, сейчас методика проходит клинические испытания в группе UCSF [68]. Подслизистый слой кишечной стенки привлекателен из-за простого доступа и наличия желаемого сброса в портальный кровоток, однако в этом случае отсутствует достаточное количество места для размещения клеток при пересадках у людей [69]. Упомянутые предварительные результаты альтернативных локализаций вдохновляют, однако необходимы масштабные клинические исследования для подтверждения безопасности и эффективности.
Иммунная терапия при трансплантации клеток островков Лангерганса
ИСТ при трансплантации клеток ОЛ сложна. Как и любая пересадка органа, ИСТ, по современным протоколам, предотвращает отторжение пересаженной ткани у реципиента, но при этом имеет токсичные побочные эффекты со стороны других органов и увеличивает риск инфекций и злокачественных новообразований [70]. Согласно Эдмонтонскому протоколу, индукция с применением даклизумаба, моноклональных антител к ИЛ-2 позволяет установить менее диабетогенный режим лечения без применения кортикостероидов и с комбинацией сиролимуса с низкими дозами такролимуса в качестве иммуносупрессивной поддержки [71, 72].
Даклизумаб хорошо переносится больными и дает минимальные побочные эффекты, но не является сильнодействующим препаратом. Применение тимоглобулина с первичным угнетением Т-лимфоцитов оказывает выраженный положительный эффект в отношении долгосрочной инсулиннезависимости без учета выбора иммуносупрессивной поддержки [73]. Хорошие результаты с супрессией Т-лимфоцитов алемтузумабом (антитела к CD-52) были получены в группе реципиентов по показателям силы действия, переносимости, стойкости эффекта и затратам. Сообщалось о том, что пациенты хорошо переносят алемтузумаб в комбинации с индукцией этанерцептом. Получены намного более высокие пятилетние показатели инсулиннезависимости после трансплантации клеток ОЛ по сравнению с терапией большими дозами сиролимуса, такролимуса и моноклональными антителами к ИЛ-2, примененными в первых группах больных, пролеченных по Эдмонтонскому протоколу [31]. Влияние алемтузумаба на подавление иммунной системы у реципиентов после пересадки клеток ОЛ должны определить дальнейшие исследования у больных с впервые выявленным СД1. В настоящее время группа исследователей из Университета Миннесоты проверяют действие ортоклона ОКТ-3, гуманизированных антиcd3-специфичных антител в качестве агента индукции с поддержкой сиролимусом и такролимусом. Терапия антиcd3-антителами угнетает эффекторные Т-лимфоциты и переключает иммунный ответ на T-хелперы 2-го типа. Применение антиcd3-антител, как сообщается, индуцирует толерантность при неаутоиммунных моделях аллотрансплантации, а также замедляет прогрессирование недавно выявленного СД у людей.
Поддержка иммуносупрессии после трансплантации остается проблемой при пересадке клеток О.Л. Ингибитор кальциневрина — ИКН (циклоспорин или такролимус), используемый в качестве одного из препаратов для подавления иммунного ответа, является высокоэффективным ингибитором отторжения и рецидива аутоиммунного процесса [74]. Однако препарат нарушает функцию почек, приводит к головной боли и является токсичным в отношении β-клеток. Сиролимус работает через блокировку ответа T- и B-лимфоцитов на выброс цитокинов, которые участвуют в стимулировании, активации и экспансии T- и В-лимфоцитов.
До применения у людей обоснованность использования сиролимуса в качестве эффективного иммуносупрессивного препарата была подтверждена в экспериментах на собаках и в дальнейшем на свиньях. Сиролимус был ключевым препаратом первоначального Эдмонтонского протокола и исследований консорциума CIT. Ряд клиник получили многообещающие результаты по переносимости побочных эффектов в протоколах с mTOR-ингибиторами. Очевидно, что режим иммуносупрессии без применения такого ИКН, как такролимус, может обеспечивать иммунопротективный эффект с меньшими отрицательными воздействиями, что было бы высокоэффективно при заместительной терапии клетками ОЛ.
Известно, что неспецифическая воспалительная реакция возникает в перитрансплантатном периоде на микроуровне в среде пересаженной ткани ОЛ, что приводит к ранней потере трансплантата и снижает его функцию. Пересаженные клетки ОЛ вскоре после процедуры оказываются в портальных венулах в «ловушке» и подвергаются иммунной атаке. Противовоспалительное блокирование выброса ФНО-α этанерцептом в комбинации с антагонистом рецептора ИЛ-1, таким как анакинра, для приживления островков, по данным ряда клинических испытаний, дает вероятный благоприятный эффект.
Упомянутые современные противовоспалительные препараты, которые могут эффективно ингибировать неспецифическое воспаление сразу после пересадки, должны стать предметом дальнейших исследований, чтобы улучшить результаты трансплантации клеток ОЛ.
Блокада иммунорегуляторных путей, индукция Treg, таргетирование дендритных клеток и противовоспалительные препараты могут стать потенциальными вариантами обеспечения иммуносупрессии. За этими направлениями стоит совершенствование подавления иммунного ответа при аллогенной трансплантации клеток ОЛ в перспективе.
Достижение продолжающейся толерантности реципиента по отношению к аллотрансплантату ОЛ остается самой важной задачей, стоящей перед исследователями, которые рассчитывают найти способ полностью отказаться от необходимости угнетения иммунитета реципиента. Инкапсуляция клеток — один из новых методов блокирования иммунной системы и спасения пересаженной ткани от разрушения путем создания мембраны вокруг ОЛ [75].
Мембрана, окружающая ОЛ, содержит поры достаточно большого размера, чтобы пропускать питательные вещества и инсулин для обмена между хозяином и пересаженной тканью, но при этом не пропускает клетки иммунной системы и защищает ОЛ от их воздействия [76]. Подобные устройства прошли клинические испытания 1-й и 2-й фазы. Однако при существующих методах поддержания жизнеспособности и функции ОЛ, последние все же повреждаются и не устраняют у пациентов нечувствительность к развитию гипогликемии, тяжелые гипогликемические приступы или зависимость от инсулина.
Осложнения трансплантации островков Лангерганса
Риск летальности после трансплантации клеток ОЛ является чрезвычайно низким. Задокументированный показатель летальности объединенного реестра по трансплантации островковых клеток (CITR) составляет 2,9%. Большинство случаев связано с длительно существующими осложнениями СД1 со стороны внутренних органов, и только в 3 из 25 смертельных случаев была подтверждена связь с пересадкой или вмешательством по поводу отторжения [77].
Использование стандартного УЗ-контроля и чрескожного чреспеченочного доступа к воротной вене обеспечивает данному методу низкий трансплантационный риск. Тем не менее возможны осложнения, тромбоз воротной вены и кровотечение — главные осложнения после внутрипеченочной трансплантации клеток ОЛ [78]. Их частота может быть снижена при соблюдении протоколов терапии антикоагулянтами и местном применении пасты, облитерирующей раневой канал от катетера.
Временный дискомфорт и боль разной степени интенсивности в месте постановки катетера могут наблюдаться у 50% пациентов, но при этом купируются в течение 24—48 ч при помощи традиционных анальгетиков. Возможно также в 50% случаев увеличение уровня печеночных ферментов (АЛТ, АСТ), который возвращается к норме в течение 30 сут без целенаправленного лечения [79].
Сообщалось о бактериальной контаминации очищенной подготовленной для трансплантации клеточной массы, а также о непреднамеренном введении контаминированного трансплантата, однако клинически доказанных системных событий не наблюдалось. Если О.Л. были получены от нескольких доноров, возможна сенсибилизация реципиента по главному комплексу гистосовместимости. Данные риски минимизируются при отказе от нескольких доноров и проведении терапии по супрессии индукции Т-лимфоцитов. Хроническая иммуносупрессия может приводить к злокачественным новообразованиям. У 17 (2%) из 874 пациентов отмечено возникновение поддающегося лечению рака кожи.
Результаты трансплантации клеток островков Лангерганса
Методика клинической трансплантации ОЛ постоянно совершенствовалась в течение последних 30 лет, явные достижения отмечены в области их получения и клинических исходов с восстановлением секреции инсулина и купированием гликемической нестабильности у больных СД1 [80]. В 2000 г. Эдмонтонская группа сообщила о серии из 7 последовательно отобранных пациентов, достигших инсулиннезависимости после трансплантации ОЛ от множественных доноров и получавших сиролимус без использования стероидов [72]. Это стало главной вехой в клинической аллотрансплантации ОЛ. В отличие от предыдущих выборок в качестве реципиентов были отобраны пациенты без уремии, с лабильным СД, каждому из которых вводили минимум 10 000 IEQ/кг. К маю 2003 г. в Альбертском университете Эдмонтона была выполнена 51 аллогенная пересадка О.Л. Совокупная выживаемость составила 100%. Инсулиннезависимость через 1 и 3 года после трансплантации составила 79 и 50% соответственно. У 88% пациентов отмечено функционирование пересаженной ткани спустя 3 года после трансплантации. При сравнении результатов пересадки ОЛ и ПЖ целиком выявлено, что уровень HbA1c оставался в нормальном диапазоне у большинства пациентов в течение последующих 3 лет.
В 2006 г. A. Shapiro и соавт. [81] представили результаты мультицентрового проспективного исследования, проведенного совместно с национальными институтами здоровья (National Institutes of Health) и сетью исследовательских центров по изучению иммунологической переносимости (Immune Tolerance Network) в 6 клиниках Северной Америки и 3 клиниках Европы, по изучению выполнимости Эдмонтонского протокола. Одной из задач явилось создание центров передового опыта для будущих исследований иммунологической переносимости.
Протокол стандартизовал отбор образцов ПЖ, процесс получения клеток ОЛ, критерии готового продукта, отбор реципиентов и их ведение после трансплантации. Всего было выполнено 77 пересадок ОЛ 36 пациентам в 9 клиниках. Основной конечной точки — инсулиннезависимости достигли 44% пациентов: HbA1c менее 6,5%, уровень глюкозы после вечернего приема пищи до 140 мг/дл более 3 раз в неделю, 2-часовой уровень глюкозы после приема пищи до 180 мг/дл более 4 раз в неделю. Через 2 года после пересадки 76% пациентов стали инсулинозависимыми. C-пептид был обнаружен у 70%, все больные с остаточной функцией ОЛ были избавлены от тяжелой гипогликемии и гипергликемии.
Исследователи отмечали, что наличие предшествующего опыта в каждом случае значительно влияло на достижение основной конечной точки, а регионализация центров по пересадке потенциально может снизить затраты и улучшить результаты.
Исследование продемонстрировало, что трансплантация ОЛ, выполненная по Эдмонтонскому протоколу, может восстановить долгосрочную эндогенную секрецию инсулина и гликемическую устойчивость. Несмотря на то что инсулиннезависимость не была достигнута, постоянная функция островков избавила реципиентов от тяжелой гипогликемии и улучшила показатели HbA1c. А. Gangemi и соавт. [82] сообщили, что в дополнение к Эдмонтонскому протоколу сочетанная терапия этанерцептом и эксенатидом улучшает функцию трансплантата и облегчает достижение инсулиннезависимости при введении меньшего количества островков.
Впоследствии Эдмонтонская группа сообщила о долгосрочном исследовании эффективности и безопасности трансплантации островков у 7 пациентов с СД1 в США. У данных больных подтверждена постоянная функция ОЛ, что зарегистрировано в многоцентровом международном Эдмонтонском протоколе [83]. Пациенты наблюдались в течение 12 лет с последовательным тестированием на продленное функционирование аллотрансплантата, оцениваемое по уровню C-пептида. Все 7 человек продемонстрировали продленную функцию ОЛ в течение более 10 лет от момента первичной трансплантации. У всех больных выявлено прогрессивное снижение соотношения C-пептид/глюкоза. Ни у кого из них не отмечено тяжелой гипогликемии, оппортунистической инфекции или лимфомы.
Таким образом, несмотря на низкую продолжительность инсулиннезависимости, доказано, что Эдмонтонский протокол является безопасным в долгосрочном периоде наблюдения. В настоящее время методика показана прежде всего пациентам с угрожающими жизни состояниями в анамнезе — тяжелой гипогликемией и нечувствительностью к развитию гипогликемии. Для них трансплантация клеток ОЛ была бы крайне эффективной в ближайшем и отдаленном периодах. Согласно последней презентации CITR, выполнено 1055 аллогенных трансплантаций в 50 центрах трансплантации в Северной Америке, Европе, Австралии и Южной Корее (IPITA, IXA, Совместная конференция CTS в Мельбурне, 2015) [80].
Среди упомянутых случаев изолированная пересадка клеток ОЛ (ITA) была самой частой процедурой (n
=858), за которой следовали трансплантация клеток ОЛ после пересадки почки (IAK) и одномоментная пересадка ОЛ и почки (SIK) (
n
=197). Данные CITR выявили факторы, влияющие на успешный исход и достижение инсулиннезависимости при возрасте реципиента старше 35 лет, введении в общей сложности более 0,5 млн ед. эквивалента ОЛ (IEQ), индексе стимуляции глюкозы более 1,5, индукционной терапии с ингибированием T-клеток и ФНО-α, поддержке ИКН и mTOR. Сочетание данных факторов привело к стабильной инсулиннезависимости через 5 лет у 60% из 60 пациентов. Возраст реципиента, IEQ и поддержка ИКН также были предикторами хороших уровней C-пептида (≥0,3 нг/мл;
n
=308) и HbA1c (<6,5% или снижение на 2% и более;
n
=530). Возраст и IEQ определяли отсутствие приступов тяжелой гипогликемии (менее 90% пациентов в течение 5 лет). Еще одним показателем совершенствования методики стало значительное снижение числа неблагоприятных событий за последние 5 лет у 80% пациентов.
Позднее были представлены результаты клинических испытаний 3-й фазы многоцентрового несравнительного исследования [77]. Работа проводилась в 8 клиниках Северной Америки. Зарегистрированы 48 взрослых с СД1, продолжающимся более 5 лет, с отсутствием C-пептида после стимуляции, с зарегистрированными внезапными приступами гипогликемии и тяжелыми гипогликемическими приступами, несмотря на тщательный контроль. Каждый получал иммуносупрессивную терапию и прошел одну или несколько пересадок, выполненных при соблюдении принципов надлежащей практики и методов контроля. Основная конечная точка была успешно достигнута у 87,5% пациентов через 1 год и у 71% пациентов через 2 года.
Средний уровень HbA1c составил 5,6% (38 ммоль/моль) через 1 и 2 года. Чувствительность к развитию гипогликемии была восстановлена с выраженной положительной динамикой по шкалам Clarke и HYPO (p
<0,0001). Летальных исходов или случаев инвалидизации в исследовании не зафиксировано. У 5 (10,4%) участников возникло кровотечение, потребовавшее гемотрансфузии (соответствует 5 из 75 процедур), и в 2 (4,1%) случаях возникли инфекции, ассоциированные с иммуносупрессией. Показатель клубочковой фильтрации выраженно снижался на фоне угнетения иммунной системы, продукция донор-специфических антител отмечена у 2 пациентов.
В ходе данного исследования сделан вывод о том, что пересадка донорских ОЛ обеспечивает контроль над гликемией, восстановление чувствительности к ее развитию и защищает пациентов от тяжелых гипогликемических приступов. Зарегистрированные события, связанные с безопасностью, относились к технике манипуляции и ИСТ, что включало кровотечение и снижение функции почек.
Следовательно, трансплантацию клеток ОЛ следует рассматривать для тех пациентов с СД1 и нечувствительностью к развитию гипогликемии, у которых менее агрессивное проводимое лечение остается неэффективным в части предотвращения тяжелых приступов гипогликемии.
Таким образом, результаты последних исследований подтверждают важность трансплантации клеток ОЛ с целью предотвращения тяжелых приступов гипогликемии и нечувствительности к развитию гипогликемии, а также для стабильного контроля гликемии у большинства пациентов с СД1 без учета зависимости от инсулина. Вероятно, дальнейшее совершенствование методик получения и пересадки клеток ОЛ приведет к более благоприятным исходам заболевания. Накопленный опыт трансплантации клеток ОЛ является хорошей основой для клинических поисков альтернативных источников трансплантации β-клеток.
Авторы заявляют об отсутствии конфликта интересов.
Островки лангерганса поджелудочной железы
Группы таких клеток были обнаружены еще в 1869 ученым Паулом Лангергансом, в честь которого и названы. Клетки островков концентрированы преимущественно в хвосте поджелудочной железы и составляют 2% от массы органа. Всего в паренхиме насчитывается около 1 млн. островков.
Выявлено, что у новорожденных островки занимают 6% от всей массы органа. По мере взросления организма удельный вес структур, имеющих эндокринную активность, снижается. К 50-ти годам их остается всего 1-2%. В течение суток островки Лангерганса секретируют 2 мг инсулина.
Из каких клеток состоят островки?
Островки Лангерганса имеют в составе разные, морфологически и функционально, клетки.
Эндокринный сегмент поджелудочной железы включает:
- Альфа-клетки – продуцируют глюкагон, который является антагонистом инсулина и обеспечивает повышение уровня глюкозы в плазме крови. Занимают 20% от массы остальных клеток.
- Бета-клетки – синтезируют инсулин и амелин. Они составляют 80% от массы островка.
- Дельта-клетки – обеспечивают выработку соматостатина, который может угнетать секрецию других желез. Этих клеток от 3 до 10% от общей массы.
- РР-клетки – продуцируют панкреатический полипептид. Он отвечает за усиление желудочной секреции и подавление функции поджелудочной железы.
- Эпсилон-клетки – выделяют грелин, который отвечает за возникновение чувства голода.
Зачем нужны островки и как они устроены?
Островки Лангерганса отвечают за поддержание баланса углеводов в организме и работу других эндокринных органов. Они имеют обильное кровоснабжение, иннервируются блуждающими и симпатическими нервами. Среди островков находятся нейроинсулярные комплексы. Онтогенетически клетки островков образуются из эпителиальной ткани.
Островок имеет сложное строение и каждый из них является полноценным функционально активным образованием.
Его структура способствует обмену биологически активными веществами между другими железами для одновременной секреции инсулина. Клетки островков размещены в виде мозаики, то есть, перемешаны между собой.
Экзокринная структура поджелудочной железы может быть представлена скоплениями нескольких клеток и крупными островками.
Известно, что зрелый островок в паренхиме имеет упорядоченную организацию. Он окружен соединительной тканью, имеет дольки, а внутри проходят кровеносные капилляры. Центр дольки заполнен бета-клетками, а на периферии расположились альфа- и дельта-клетки. Можно сказать, что строение островка напрямую связано с его размером.
В чем заключается эндокринная функция островков и почему против них образуются антитела?При взаимодействии островковых клеток формируется механизм обратной связи. Клетки оказывают влияние на рядом расположенные:
- Инсулин оказывает активирующее влияние на бета-клетки и угнетает альфа-клетки.
- Глюкагон активирует альфа-клетки, которые в свою очередь воздействуют на дельта-клетки.
- Соматостатин угнетает работу альфа- и бета-клеток.
При нарушении иммунных механизмов против бета-клеток образуются антитела, которые их разрушают и приводят к развитию сахарного диабета.
Для чего делают пересадку островков?
Трансплантация островкового аппарата служит достойной альтернативой пересадке поджелудочной железы или установке искусственного органа. Такое вмешательство дает шанс больным сахарным диабетом восстановить структуру бета-клеток.
Проводились клинические исследования, в которых больным сахарным диабетом 1 типа были пересажены островковые клетки от доноров. В результате испытаний, выявлено, что такое вмешательство приводит к восстановлению регуляции уровня углеводов.
Больным сахарным диабетом проводится мощная иммуносупрессивная терапия, для предупреждения отторжения донорских тканей.
Альтернативным источником материала для восстановления островков являются стволовые клетки. Они могут быть актуальными, так как резервы донорских клеток ограничены.
Регенерационная медицина быстро развивается, предлагает новые методы лечения во многих областях
Важно восстановить толерантность иммунной системы, так как новые пересаженные клетки также будут разрушены через определенный промежуток времени.
Имеет перспективу ксенотрансплантация – пересадка поджелудочной железы от свиньи. До открытия инсулина, экстракты из свиной поджелудочной использовали для лечения сахарного диабета.
Известно, что инсулин человека и свиной отличается только одной аминокислотой.
Изучение строения и функции островков Лангерганса имеет большие перспективы, так как сахарный диабет развивается из-за поражения их структуры.
Автор: Никулина Наталья Викторовна,специально для сайта Moizhivot.ru
о поджелудочной железе
Источник:
Определение антител к островкам Лангерганса
Если в организме по каким-то причинам произошел сбой в организме, и началась активная выработка антител против собственных тканей, это приводит к трагичным последствиям. Когда воздействию антител подвергаются бета-клетки, развивается сахарный диабет I типа, связанный с недостаточной выработкой инсулина. Каждый вид образующихся антител действует против определенного вида белка. В случае с островками Лангерганса — это структуры бета-клеток, отвечающие за синтез инсулина. Процесс протекает прогрессивно, клетки полностью погибают, нарушается углеводный обмен и при нормальном питании больной может умереть от голода из-за необратимых изменений в органах.
Разработаны диагностические методы определения наличия антител к инсулину в организме человека. Показаниями к такому исследованию являются:
- ожирение с учетом семейного анамнеза,
- любая патология ПЖ, включая перенесенные травмы,
- тяжелые инфекции: в основном вирусные, которые могут стать толчком к развитию аутоиммунного процесса,
- тяжелые стрессы, психическое перенапряжение.
Существует 3 типа антител, благодаря которым диагностируется сахарный диабет I типа:
- к декарбоксилазе глутаминовой кислоты (одна из заменимых аминокислот в организме),
- к вырабатывающемуся инсулину,
- к клеткам ОЛ.
Это своеобразные специфические маркеры, которые необходимо включать в план обследования пациентов с имеющимися факторами риска. Из перечисленного объема исследований выявление антител к компоненту глутаминовой аминокислоты является ранним диагностическим признаком СД. Они появляются, когда клинические признаки болезни еще отсутствуют. Определяются в основном в молодом возрасте и могут быть использованы для выявления людей с предрасположенностью к развитию болезни.
Как устроены и для чего нужны островки
Основная функция, которую выполняют островки Лангерганса – поддержание правильного уровня углеводов в организме и контроль над другими эндокринными органами. Островки иннервируются симпатическими и блуждающими нервами и обильно снабжаются кровью.
Островки Лангерганса в поджелудочной имеют сложную структуру. По сути, каждый из них являет собой активное полноценное функциональное образование. Строение островка обеспечивает обмен между биологически активными веществами паренхимы и другими железами. Это необходимо для слаженной секреции инсулина.
Клетки островков перемешаны между собой, то есть, расположены в виде мозаики. Зрелый островок в поджелудочной железе имеет правильную организацию. Островок состоит из долек, которые окружает соединительная ткань, внутри клеток проходят кровеносные капилляры.
В центре долек находятся бета-клетки, в периферическом же отделе расположены альфа и дельта-клетки. Поэтому строение островков Лангерганса полностью зависит от их размеров.
Почему против островков образуются антитела? В чем заключается их эндокринная функция? Оказывается, при взаимодействии клеток островков развивается механизм обратной связи, и тогда эти клетки оказывают влияние на другие клетки, расположенные поблизости.
- Инсулин активизирует функцию бета-клеток и угнетающе действует на альфа-клетки.
- Альфа-клетки активизирует глюкагон, а те воздействуют на дельта-клетки.
- Работу альфа и бета-клеток угнетает соматостатин.
Важно! При сбое иммунных механизмов образуются направленные против бета-клеток иммунные тела. Клетки разрушаются и приводят к страшному заболеванию, носящему название «сахарный диабет»
Профилактика: как сохранить островковый аппарат?
Так как функция островков Лангерганса поджелудочной железы − вырабатывать важные для человека вещества, то для сохранения здоровья этой части ПЖ необходима модификация образа жизни. Основные пункты:
- отказ от алкоголя и курения,
- исключение вредной пищи,
- физическая активность,
- сведение к минимуму острых стрессов и нервно-психических перегрузок.
Наибольший вред поджелудочной железе приносит алкоголь: он разрушает ткани ПЖ, приводит к панкреонекрозу — тотальной гибели всех видов клеток органа, которые восстановить невозможно.
К аналогичным последствиям приводит излишнее употребление жирной и жареной пищи, особенно если это происходит натощак и регулярно. Нагрузка на ПЖ значительно возрастает, количество ферментов, которые необходимы для переваривания большого количества жиров, увеличивается и истощает орган. Это приводит к фиброзу и изменениям в остальных клетках железы.
Поэтому при малейших признаках нарушения пищеварительных функций рекомендуется обратиться к гастроэнтерологу или терапевту с целью своевременной коррекции изменений и ранней профилактики осложнений.
Заболевания клеток островков Лангерганса
Клеточная система островков Лангерганса в железе может подвергаться разрушению.
Это происходит при протекании следующих патологических процессов: аутоиммунных реакций, онкологии, панкреонекрозе, острой форме экзотоксикозах, эндотоксикозах, системных заболеваниях.
Также подвержены заболеванию люди пожилого возраста. Недуги протекают при наличии серьезного разрастания разрушений.
Это происходит при подверженности клеток опухолевидным явлениям. Сами же новообразования являются гормонопродуцирующими, а потому сопровождаются признаками сбоя гиперфункции органа поджелудочной железы.
Есть несколько видов патологий, связанных с деструкцией железы. Критической норма является, если потеря составляет более 80 процентов участков островков Лангерганса.
При деструкции поджелудочной выработка инсулина нарушена, а потому гормона недостаточно, чтобы переработать поступивший в организм сахар.
В виду данного сбоя и наблюдается развитие диабета. Стоит отметить, что под сахарным диабетом первой и второй степени необходимо понимать две разные патологии.
Во втором случае рост уровня сахара будет иметь связь с тем фактом, что клетки не восприимчивы к инсулину. Что же касается функционирования зон Лангерганса, то они работают в прежнем режиме.
Разрушение структур, которые являются гормонообразующими, провоцируют развитие сахарного диабета. Подобное явление характеризуется рядом признаков сбоя.
К ним стоит отнести появление сухости во рту, постоянной жаждой. При этом могут быть приступы тошноты или же повышенная нервная возбудимость.
Человек может столкнуться с бессонницей и резким сбросом веса тела, несмотря на то, что питается усиленно.
Если же в организме повышается уровень сахара, не исключено, что во рту появиться неприятный ацетоновый запах. Возможно, нарушение сознания и гипергликемическое состояние комы.
Из вышеуказанной информации стоит сделать вывод, что клетки поджелудочной железы способны выработать ряд нужных организму гормонов.
Без них будет нарушена полноценная жизнедеятельность организма. Осуществляют данные гормоны углеводный обмен и ряд анаболических процессов.
Деструкция зон приведет к развитию осложнений, связанной с необходимостью проведения гормональной терапии в последующем.
Чтобы избежать необходимости развития подобных событий, рекомендуется придерживаться особых рекомендаций специалистов.
В основном они сводятся к тому, что не стоит в больших дозах потреблять спиртные напитки, важно своевременно лечить инфекционные патологии и аутоиммунные сбои в организме, посещать доктора при первых признаках болезни, связанной с поражением поджелудочной железы, да и иных органов, входящих в ЖКТ. .
Препараты инсулина
В настоящее время фармацевтическая промышленность производит значительное число препаратов инсулина, имеющих различные биологические эффекты. Выделяют человеческий, свиной инсулины, инсулин крупного рогатого скота. По степени очистки различают традиционные, монопиковые, монокомпонентные инсулины. По времени действия выделяют инсулины короткого и пролонгированного действия. Последние делятся на инсулины среднего, длительного и сверхдлительного срока действия. Есть также инсулины ультракороткого и депо-инсулины, выделяющиеся медленно из подкожной клетчатки.
Подбор схемы инсулинотерапии – сложное и очень ответственное мероприятие. От правильности выбора формы инсулина и схемы его дозирования зависит успешность достижения компенсации сахарного диабета и, как следствие, качество жизни пациента.
Что такое пересадка и зачем она нужна
Достойной альтернативой пересадки паренхимы железы является трансплантация островкового аппарата. В этом случае установка искусственного органа не потребуется. Пересадка дает шанс диабетикам восстановить структуру бета-клеток и пересадка поджелудочной железы не требуется в полном объеме.
На основании клинических исследований было доказано, что у больных сахарным диабетом типа 1, которым были пересажены донорские островковые клетки, полностью восстанавливается регуляция уровня углеводов. Чтобы предупредить отторжение донорских тканей, таким пациентам проводилась мощная иммуносупрессивная терапия.
Для восстановления островков существует и другой материал – стволовые клетки. Поскольку резервы донорских клеток не безграничны, такая альтернатива является весьма актуальной.
Для организма очень важно восстановить восприимчивость иммунной системы, иначе вновь пересаженные клетки будут отторгаться или разрушаться через некоторое время. . Сегодня быстро развивается регенерационная терапия, она предлагает новые методики во всех областях
Перспективна и ксенотрансплантация – пересадка человеку свиной поджелудочной железы.
Сегодня быстро развивается регенерационная терапия, она предлагает новые методики во всех областях. Перспективна и ксенотрансплантация – пересадка человеку свиной поджелудочной железы.
Экстракты паренхимы свиньи использовались для лечения сахарного диабета еще до открытия инсулина. Оказывается человеческая и свиная железы отличаются лишь одной аминокислотой.
Поскольку сахарный диабет развивается вследствие поражения островков Лангерганса, их изучение имеет большие перспективы для эффективного лечения заболевания.
Трансплантация островковых клеток
Трансплантация клеток ОЛ является альтернативой пересадке поджелудочной железы или ее части, а также установке искусственного органа. Связано это с высокой чувствительностью и нежностью тканей ПЖ к любым воздействиям: она легко травмируется и с трудом восстанавливает свои функции.
Пересадка островков сегодня дает возможность лечить сахарный диабет I типа в тех случаях, когда инсулинзамещающая терапия достигла пределов и становится малоэффективной. Метод впервые применен канадскими специалистами и заключается во введении пациенту при помощи катетера здоровых эндокринных донорских клеток в воротную вену печени. Он направлен на то, чтобы заставить работать и сохранившиеся собственные бета-клетки.
За счет функционирования пересаженных постепенно синтезируется необходимое для поддержания нормального уровня глюкозы крови количество инсулина. Эффект наступает быстро: при удачно проведенной операции через две недели состояние больного начинает улучшаться, заместительная терапия сходит на нет, ПЖ начинает самостоятельно синтезировать инсулин.
Опасность операции заключается в отторжении пересаженных клеток. Используются трупные материалы, которые тщательно подбираются по всем параметрам совместимости тканей. Поскольку таких критериев существует около 20, антитела, присутствующие в организме, могут привести к разрушению тканей поджелудочной железы. Поэтому важную роль играет правильное медикаментозное лечение, направленное на снижение иммунных реакций. Препараты подбираются таким образом, чтобы избирательно блокировать некоторые из них, влияющие на выработку антител, к клеткам пересаженных островков Лангерганса. Это позволяет до минимума снизить риск для поджелудочной железы.
На практике пересадка клеток ПЖ при сахарном диабете I типа показывает хорошие результаты: зафиксированных смертельных случаев после такой операции не отмечалось. Определенное количество больных значительно снизило дозу инсулина, а часть прооперированных пациентов перестала в нем нуждаться. Восстановились и другие нарушенные функции органа, улучшилось самочувствие. Значительная часть вернулась к нормальному образу жизни, что позволяет надеяться на дальнейший благоприятный прогноз.
Как и при пересадке других органов, операция на ПЖ, помимо отторжения, опасна другими побочными явлениями за счет нарушения разной степени секреторной деятельности поджелудочной железы. В тяжелых случаях это приводит:
- к панкреатическим поносам,
- к тошноте и рвоте,
- к выраженному обезвоживанию,
- к другим диспепсическим явлениям,
- к общему истощению.
После проведенной процедуры на протяжении всей жизни пациент должен непрерывно получать иммуносупрессорные препараты, чтобы предотвратить отторжение чужеродных клеток. Действие этих лекарств направлено на снижение иммунных реакций — выработку антител. В свою очередь, отсутствие иммунитета увеличивает риск развития любой, даже простой инфекции, которая может осложниться и вызвать серьезные последствия.
Продолжаются исследования по пересадке ПЖ от свиньи — ксенотрансплантация. Известно, что анатомия железы и свиной инсулин наиболее приближены к человеческим и отличаются от него одной аминокислотой. До открытия инсулина в лечении тяжелого сахарного диабета использовался экстракт из поджелудочной железы свиньи.
Зачем проводят пересадку?
Поврежденные ткани ПЖ не восстанавливаются. В случаях осложненного сахарного диабета, когда пациент находится на высоких дозах инсулина, такое оперативное вмешательство спасает больного, дает шанс на восстановление структуры бета-клеток. В ряде клинических исследований больным пересаживались эти клетки от доноров. В результате восстанавливалась регуляция углеводного обмена. Но притом пациентам приходится проводить мощную иммуносупрессивную терапию, чтобы не произошло отторжение донорских тканей.
Не всем пациентам с сахарным диабетом I типа показана трансплантация клеток. Существуют строгие показания:
- отсутствие результатов от применяемого консервативного лечения,
- резистентность к инсулину,
- выраженные метаболические нарушения в организме,
- тяжелые осложнения болезни.
Где проводят операцию и сколько стоит?
Процедуру замещения островков Лангерганса широко проводят в США — таким образом лечат диабет любого типа на ранних стадиях. Этим занимается один из институтов по диабетическим исследованиям в Майами. Полностью вылечить СД таким способом не удается, но достигается хороший терапевтический эффект, притом риски тяжелых осложнений сводятся к минимуму.
Цена такого вмешательства составляет порядка 100 тыс. $. Послеоперационная реабилитация и проведение иммунодепрессивной терапии составляет от 5 до 20 тыс. $. Стоимость этого лечения после проведения операции зависит от реакции организма на пересаженные клетки.
Практически сразу после проведенной манипуляции ПЖ начинает нормально функционировать самостоятельно, и постепенно ее работа улучшается. Процесс восстановления занимает примерно 2 месяца.
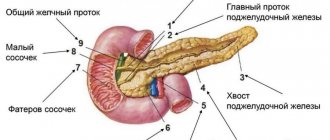
Поджелудочная железа
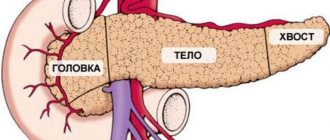
Орган относится к эндокринной и пищеварительной системам. Он вырабатывает ферменты, расщепляющие поступившую пищу в организм. Также и гормоны, регулирующие углеводный и жировой обмены. Поджелудочная железа состоит из долек, каждая из которых вырабатывает необходимые организму вещества – ферменты. По форме она похожа на вытянутую запятую. Весит от 80 до 90 г. Располагается орган позади желудка.
Железа состоит из:
- головки;
- шейки;
- тела (треугольной формы);
- хвоста (грушевидного).
Важно. Орган снабжен кровеносными сосудами, выводящими протоками
Через всю железу проходит канал, по которому выработанный панкреатический сок выводится в двенадцатиперстную кишку.
К ферментам, которые вырабатывает поджелудочная железа, относятся:
- амилаза;
- лактаза;
- трипсин;
- липаза;
- инвертаза.
Особые клетки, инсулоциты, осуществляют эндокринную миссию поджелудочной железы. Они вырабатывают следующие гормоны:
- Гастрин.
- Инсулин.
- С-пептид.
- Тиролиберин.
- Глюкогон.
- Соматостатин.
Важно. Гормоны участвуют в углеводном обмене организма.
Функциональные особенности
Основным гормоном, который вырабатывается островками Лангерганса, является инсулин. Но нужно заметить, что зоны Лангерганса каждой своей клеточкой продуцируют определенные гормоны.
К примеру, альфа-клетки производят глюкагон, бета – инсулин, а дельта – соматостатин,
PP-клетки — панкреатический полипептид, эпсилон — грелин. Все гормоны оказывают влияние на углеводный обмен, понижают или же повышают уровень глюкозы в крови.
Потому, нужно сказать, что клетки поджелудочной железы выполняют основную функцию, связанную с поддержанием адекватной концентрации депонированных и свободных углеводов в организме.
Кроме этого, вещества, которые производятся железой, оказывают влияние на формирование жировой или же мышечной массы.
Также они отвечают за функциональность некоторых структур головного мозга, связанную с подавлением выработки секрета гипоталамуса и гипофиза.
Из этого стоит сделать вывод, что основные функции островков Лангерганса будут заключаться в поддержке правильного уровня углеводов в организме и контроля над иными органами эндокринной системы.
Они иннервируются блуждающими и симпатическими нервами, которые обильно снабжаются кровотоком.
Типы островковых клеток и их функции
Клетки ОЛ отличаются морфологическим строением, выполняемыми функциями, локализацией. Внутри островков они имеют мозаичное расположение. Каждый островок имеет упорядоченную организацию. В центре находятся клетки, которые выделяют инсулин. По краям – периферийные клетки, количество которых зависит от размеров ОЛ. В отличие от ацинусов, ОЛ не содержит своих протоков – гормоны поступают сразу в кровь через капилляры.
Выделяют 5 основных видов клеток ОЛ. Каждый из них синтезирует определенный вид гормона, регулируя пищеварение, углеводный и белковый обмен:
- α-клетки,
- β-клетки,
- δ-клетки,
- РР-клетки,
- эпсилон-клетки.
Альфа-клетки
Альфа-клетки занимают четверть площади островка (25%), являются вторыми по значимости: вырабатывают глюкагон — антагонист инсулина. Он контролирует процесс расщепления липидов, способствует повышению уровня сахара в крови, участвует в снижении уровня кальция и фосфора в крови.
Бета-клетки
Бета-клетки составляют внутренний (центральный) слой дольки и являются основными (60%). Они отвечают за выработку инсулина и амилина — компаньона инсулина в регуляции глюкозы крови. Инсулин выполняет несколько функций в организме, главная — нормализация уровня сахара. Если нарушается его синтез, развивается сахарный диабет.
Дельта-клетки
Дельта-клетки (10%) образуют внешний слой в островке. Они продуцируют соматостатин — гормон, значительная часть которого синтезируется в гипоталамусе (структуре головного мозга), а также обнаруживается в желудке и кишечнике.
Функционально он тесно связан также с гипофизом, регулирует работу определенных гормонов, которые вырабатываются этим отделом, а также подавляет образование и выделение гормонально-активных пептидов и серотонина в желудке, кишечнике, печени и самой поджелудочной железе.
ПП-клетки
РР-клетки (5%) располагаются по периферии, их численность примерно составляет 1/20 части островка. Они могут секретировать вазоактивный интестинальный полипептид (ВИП), панкреатический полипептид (ПП). Максимальное количество ВИП (вазоинтенсивного пептида) встречается в пищеварительных органах и мочеполовой системе (в мочеиспускательном канале). Он влияет на состояние пищеварительного тракта, выполняет много функций, в том числе обладает спазмолитическими свойствами в отношении гладкой мускулатуры желчного пузыря и сфинктеров органов пищеварения.
Эпсилон-клетки
Самые редкие из входящих в состав ОЛ — эпсилон-клетки. При микроскопическом анализе препарата из дольки ПЖ можно определить, что их число от общего состава составляет меньше 1%. Клетки синтезируют грелин. К наиболее изученной среди его многочисленных функций относится возможность влиять на аппетит.
Термины и определения
- Гистиоцитоз из клеток Лангерганса – опухоль миелоидной природы, морфологическим субстратом которой являются патологические клетки Лангерганса, фенотипически сходные с эпидермальными клетками Лангерганса
- Неактивное заболевание (НАЗ) – статус заболевания, при котором все обратимые очаги поражения претерпели обратное развитие
- Активное заболевание (АЗ) – статус заболевания, при котором сохраняются исходные или выявляются новые очаги поражения
- Реактивация заболевания – появление новых очагов поражения после достижения статуса НАЗ
- Органы риска – органы (печень, селезенка, костный мозг), вовлечение которых в патологический процесс ассоциировано с плохим прогнозом заболевания
- Перманентные осложнения (ПО) – необратимые изменения структуры и/или функции органов в исходе поражения при ГКЛ.
- Критерии ответа на терапию
Диабет
Бета клетки в поджелудочной железе сложны. Они относятся к эндокринной части поджелудочной железы. Если их лишить кислорода, она перестает выделять норму инсулина. После этого начинается диабет. Это страшная и коварная болезнь, которая полностью меняет жизнь человека.
Диабет I типа является аутоиммунным заболеванием. Здесь бета-соединения подвергаются атакам иммунной системы больного. При диабете II типа наблюдается резистентность тканей к действию инсулина. Именно поэтому происходит повышение сахара в крови. Этот недуг сокращает жизнь больного на 5-8 лет.
Новейшим способом лечения сейчас стала трансформация клеток протоков поджелудочной железы в альфа-соединения, с последующим превращением в бета клетки. В альфа клетках здесь активируется ген Pax4. Это приводит к зарождению новых бета клеток. Такую процедуру можно провести 3 раза.
Сейчас исследовательская группа работает над созданием фармакологических молекул, которые в будущем смогут исцелять больных сахарным диабетом.
Как проводится анализ?
При возникновении проблемы в работе поджелудочной железы и сбоев в ее эндокринной функции необходимо провести полное обследование. Наиболее часто причиной поражения клеток становится аутоиммунная атака. Образовавшиеся антитела можно определить при помощи лабораторной диагностики. Они могут быть трех видов:
- к самим клеточным структурам островков Лангерганса;
- вырабатываемому ими инсулину;
- мембранному ферменту бета-клеток (декарбоксилаза глутаминовой кислоты).
Важно! Обычно повреждение затрагивает не только эти группы клеток, но и весь орган в целом. Поэтому необходимо также сделать УЗИ и проверить ферментативную активность.
Примечания
- ↑Langerhans P.
Beiträge zur mikroskopischen Anatomie der Bauchspeicheldrüse : Inaugural-Dissertation, zur Erlangung der Doctorwürde in der Medicine und Chirurgie vorgelegt der Medicinischen Facultät der Friedrich-Wilhelms-Universität zu Berlin und öffentlich zu vertheidigen am 18. Februar 1869. — Berlin : Buchdruckerei von Gustav Lange, 1869. - ↑ 1234567891011
Клиническая диабетология / Ефимов А. С., Скробонская Н. А. — 1-е изд. — К.: Здоровья, 1998. — 320 с. — 3000 экз. — ISBN 5-311-00917-9. - ↑Жуковский М. А.
Детская эндокринология. — 3-е изд. — М.: Медицина, 1995. — 656 с. — 8000 экз. — ISBN 5-225-01167-5. - ↑ (англ.).
- ↑ (англ.). 26 октября 2012 года.
- ↑Прощина А. Е., Савельев С. В.
// Бюллетень экспериментальной биологии и медицины. — Изд. РАМН, 2013. — Т. 155, № 6. — С. 763—767.
Историческая справка
Пауль Лангерганс, будучи студентом-медиком, работая у Рудольфа Вирхова, в 1869 году описал скопления клеток в поджелудочной железе, отличавшиеся от окружающей ткани, названные впоследствии его именем. В 1881 году К. П. Улезко-Строганова впервые указала на эндокринную роль этих клеток. Инкреаторная функция поджелудочной железы была доказана в Страсбурге (Германия) в клинике крупнейшего диабетолога Наунина Mering и Minkowski в 1889 году — открыт панкреатический диабет и впервые доказана роль поджелудочной железы в его патогенезе. Русский учёный Л. В. Соболев (1876—1919) в диссертации «К морфологии поджелудочной железы при перевязке её протока при диабете и некоторых других условиях» показал, что перевязка выводного протока поджелудочной железы приводит ацинозный (экзокринный) отдел к полной атрофии, тогда как панкреатические островки остаются нетронутыми. На основании опытов Л. В. Соболев пришёл к выводу: «функцией панкреатических островков является регуляция углеводного обмена в организме. Гибель панкреатических островков и выпадение этой функции вызывает болезненное состояние — сахарное мочеизнурение».
В дальнейшем благодаря ряду исследований, проведенных физиологами и патофизиологами в различных странах (проведение панкреатэктомии, получение избирательного некроза бета-клеток поджелудочной железы химическим соединением аллоксаном), получены новые сведения об инкреаторной функции поджелудочной железы.
В 1907 году Lane & Bersley (Чикагский университет) показали различие между двумя видами островковых клеток, которые они назвали тип A (альфа-клетки) и тип B (бета-клетки).
В 1909 году бельгийский исследователь Ян де Мейер предложил называть продукт секреции бета-клеток островков Лангерганса инсулином (от лат. insula — островок). Однако прямых доказательств продукции гормона, влияющего на углеводный обмен, обнаружить не удавалось.
В 1921 году в лаборатории физиологии профессора J. Macleod в Торонтском университете молодому канадскому хирургу Фредерику Бантингу и его ассистенту студенту-медику Чарлзу Бесту удалось выделить инсулин.
В 1955 году Сангеру и соавторам (Кембридж) удалось определить последовательность аминокислот и строение молекулы инсулина.
В 1962 году Марлин и соавторы обнаружили, что водные экстракты поджелудочной железы способны повышать гликемию. Вещество, вызывающее гипергликемию, назвали «гипергликемическим-гликогенолитическим фактором». Это был глюкагон — один из основных физиологических антагонистов инсулина.
В 1967 году Донатану Стейнеру и соавторам (Чикагский университет) удалось обнаружить белок-предшественник инсулина — проинсулин. Они показали, что синтез инсулина бета клетками начинается с образования молекулы проинсулина, от которой в последующем по мере необходимости отщепляется С-пептид и молекула инсулина.
В 1973 году Джоном Энсиком (Вашингтонский университет), а также рядом учёных Америки и Европы была проведена работа по очистке и синтезу глюкагона и соматостатина.
В 1976 году Gudworth & Bottaggo открыли генетический дефект молекулы инсулина, обнаружив два типа гормона: нормальный и аномальный. последний является антагонистом по отношению к нормальному инсулину.
В 1979 году благодаря исследованиям Lacy & Kemp и соавторов появилась возможность пересадки отдельных островков и бета-клеток, удалось отделить островки от экзокринной части поджелудочной железы и осуществить трансплантацию в эксперименте. В 1979—1980 гг. при трансплантации бета-клеток преодолён видоспецифический барьер (клетки здоровых лабораторных животных имплантированы больным животным другого вида).
В 1990 году впервые выполнена пересадка панкреатических островковых клеток больному сахарным диабетом.
Немного истории
В 1869 году немецкий ученый Пауль Лангерганс, именем которого были названы скопления клеток в поджелудочной, впервые описал неоднородность структуры этого органа. Но только в конце 20 века возникло предположение, что они играют роль в регуляции сахарного обмена. Немного позднее были получены доказательства этой теории и открыто такое заболевание, как панкреатический диабет.
Основная часть паренхимы поджелудочной отвечает за выработку сока и ферментов. С их помощью происходит расщепление сложных веществ, поступающих с пищей, на более простые соединения, удобные для дальнейшего метаболизма.
Важно! Островки Лангерганса расположены преимущественно в хвосте поджелудочной, их клеточные структуры вырабатывают пять видов гормонов. Самый важный из них – инсулин, который участвует в обмене глюкозы, остальные играют вспомогательную роль в общей эндокринной системе.
Если говорить о том, из чего состоят островки Лангерганса, то следует отметить, что все они в совокупности представляют собой гормонально-активные скопления. Их размеры могут варьироваться от одной клетки до крупных образований более 100 мкм в диаметре. Каждый из островков окружается соединительнотканными волокнами.
Ссылки
| Диабетология |
|
| Неиммунные формысахарного диабета у детей |
|
| Осложнения лечения |
|
| Осложнениясахарного диабета | Острые (диабетическая кома) Кетоацидоз Лактатацидоз Гиперосмолярная кома Поздние Микроангиопатия (Диабетическая ретинопатия, Диабетическая нефропатия) Макроангиопатия Диабетическая стопа Диабетическая нейропатия Синдром Мориака Синдром Нобекура Поражения других органов и систем |