- Причины развития
- Особенности нейроэндокринных опухолей
- Классификация нейроэндокринных опухолей
- Виды нейроэндокринных опухолей и их симптоматика
- Диагностика заболевания
- Лечение
- Прогноз выживаемости
Нейроэндокринные опухоли (НЭО) образуются из апудоцитов, или APUD-клеток. Эти клетки разбросаны по всему организму и составляют самую древнюю часть эндокринной системы. Они одновременно похожи на нервные клетки и клетки желез внутренней секреции, так как могут реагировать на сигналы извне или изменения состояния организма, способны производить гормоны, выполняющие разные функции.
Опухоли APUD-системы встречаются редко, и их бывает сложно диагностировать. Чаще всего они возникают в желудочно-кишечном тракте, но могут поражать и другие органы. Особенность нейроэндокринных новообразований в том, что опухолевые клетки производят повышенное количество гормонов, и из-за этого могут возникать определенные симптомы.
Согласно данным американского реестра SEER, в 2004 году заболеваемость нейроэндокринными опухолями в США составила 5 случаев на 100 тысяч населения. В России статистика, к сожалению, отсутствует, но, вероятно, заболеваемость находится на аналогичном уровне.
По данным американских экспертов, распространенность нейроэндокринных опухолей ежегодно растет. В первую очередь это связывают с изменениями в характере питания, неблагоприятной экологической обстановкой.
По данным все того же реестра SEER, новообразования APUD-системы часто диагностируются на поздних стадиях: в 50% случаев опухоль успевает распространиться на окружающие ткани, в регионарные лимфоузлы, дать отдаленные метастазы.
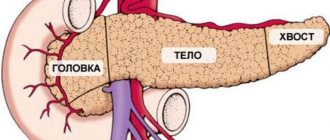
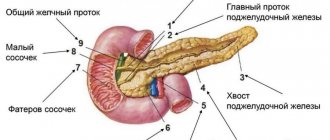
Что такое нейроэндокринная опухоль поджелудочной железы
Панкреатические нейроэндокринные новообразования (ПНЭН) представляют собой группу разных по происхождению, строению и клиническим проявлениям неоплазий (опухолей). В зависимости от того, могут ли эти опухоли секретировать гормоны и амины, вызывая карциноидный и другие клинические синдромы, их можно отнести к функциональным (Ф-НЭН) и нефункциональным (НФ-НЕН).
Нейроэндокринные новообразования поджелудочной железы — наиболее распространенные нейроэндокринные опухоли.
Большинство ПНЭН имеют низкую степень злокачественности, но обладают злокачественным потенциалом. Они растут медленно и остаются стабильными в течение многих лет, по крайней мере, когда они небольшого размера. Однако без лечения, большинство таких опухолей растет и в конечном итоге метастазирует в печень.
Новообразования поджелудочной железы в целом встречаются редко:<2% всех опухолей поджелудочной железы. Их диагностика и локализация часто требуют серьезных технологий, а их успешное лечение требует тщательного междисциплинарного подхода.
По этим причинам пациент с возможной или подтвержденной эндокринной опухолью поджелудочной железы лучше всего лечится в большом многопрофильном центре, где есть эндокринологи, гастроэнтерологи, хирурги поджелудочной железы и медицинские онкологи.
Особенности нейроэндокринных опухолей
Нейроэндокринные клетки не привязаны к какому-либо конкретному органу. Они разбросаны по всему организму. Хотя опухоли чаще всего и возникают в пищеварительном тракте, в более редких случаях они обнаруживаются и в других местах. В 15% случаев найти первичную опухоль не удается.
Нейроэндокринные опухоли могут производить гормоны, которые вызывают в органах определенные эффекты, и из-за этого пациент испытывает те или иные симптомы. Такие новообразования называют функционирующими. Если гормоны не вырабатываются — это нефункционирующая опухоль.
Классификация
Под термином нейроэндокринная опухоль поджелудочной железы обычно понимают инсулиному, гастриному или глюкагоному. Иногда к этой тройке добавляются более редкие VIPомы и соматостаниомы.
ПНЭН определяются как функциональные или нефункциональные в зависимости от того, вызывают ли они синдром гормональной гиперсекреции — избыточной продукции гормонов.
Из всех функциональных ПНЭН гастриномы и инсулиномы самые распространенные. Другие неоплазии обычно рассматриваются вместе как группа, называемая «редкими функциональными ПНЭН».
Несколько таких редких клинических синдромов были предложены в качестве возможных функциональных ПНЭН. К ним относятся следующие:
- кальцитонинома;
- паратиринома;
- опухоль, секретирующая гормон роста, секретирующая неоплазия (GRFoma);
- адренокортикотропин-гормон-секретирующая неоплазия (ACTHoma);
- нейротензинома.
По данным европейских и американских онкологов нефункциональные ПНЭН встречаются чаще, чем функциональные. Первые обычно диагностируются в четвертом или пятом десятилетиях жизни и часто уже метастазируют в печень на момент постановки диагноза.
Причины появления
10% функциональных НЭН становятся проявлением наследственных семейных эндокринных опухолей:
- синдром множественной эндокринной неоплазии 1 типа (MEN1);
- болезнь фон Гиппеля-Линдау (VHL);
- нейрофиброматоз типа 1 (NF-1);
- туберозный склероз (TSC).
Причина развития этих панкреатических нейроэндокринных новообразований — наследственное выключение в соответствующего гена-супрессора опухоли в ходе внутриутробного развития.
Хотя устаревший термин «опухоль островковых клеток» часто используется и сейчас для идентификации новообразований эндокринной поджелудочной железы — это неправильное название. Многие нейроэндокринные опухоли поджелудочной железы не развиваются непосредственно из островковых клеток.
Большинство таких новообразований возникают из стволовых клеток APUD. Это клетки-предшественники из которых впоследствии образуются все типы тканей поджелудочной железы. Они находятся в эпителии протоков этого органа.
Тот факт, что многие гастриномы и соматостатиномы находятся вблизи железистой ткани поджелудочной железы, но не внутри нее, подтверждает мнение о возможном внепанкреатическом развитии этих новообразований.
Виды нейроэндокринных опухолей и их симптоматика
Так как существуют разные типы нейроэндокринных опухолей, и они могут находиться в разных органах, то и симптомы различаются. Можно выделить три основные группы проявлений. Первая — это общие симптомы, характерные для любого типа рака: слабость, повышенная утомляемость, снижение аппетита, потеря веса без видимой причины.
Вторая группа симптомов связана с локализацией опухоли и ее размерами, сдавлением анатомических структур и нарушением функции пораженного органа. Беспокоят боли в определенной части тела, тошнота, упорный хронический кашель, расстройства стула, мочеиспусканий, кровотечения, необычные выделения. При поражении печени, желчных протоков, поджелудочной железы развивается механическая желтуха.
Третья группа симптомов вызвана гормонами, которые продуцируют нейроэндокринные клетки:
- диарея — жидкий стул более трех раз в сутки;
- постоянная жажда, голод, частые мочеиспускания, — признаки повышения уровня глюкозы в крови;
- повышенная утомляемость, раздражительность, дрожь, головокружение, судороги, потери сознания — признаки снижения уровня глюкозы в крови;
- язвенная болезнь, которая не поддается лечению;
- тревожность;
- сыпь на коже.
Нейроэндокринные опухоли желудочно-кишечного тракта
Желудочно-кишечный тракт — наиболее распространенное место локализации нейроэндокринных опухолей. Такие новообразования часто называют карциноидными опухолями. Частота поражения разных отделов пищеварительного тракта:
- тонкая кишка — 39%;
- прямая кишка — 15%;
- червеобразный отросток (аппендикс) — 7%;
- толстая кишка — 5–7%;
- желудок — 2–4%.
Опухоли в пищеварительном тракте вызывают классический карциноидный синдром. Он проявляется в виде покраснения и ощущения тепла в области лица, диареей, одышкой, симптомами, напоминающими бронхиальную астму, слабостью, учащенным сердцебиением, увеличением веса без видимой причины, высоким артериальным давлением, его частыми колебаниями.
Другие нейроэндокринные опухоли
Вторым по частоте местом локализации опухолей APUD-системы после НЭО ЖКТ являются легкие. Примерно в 30% случаев нейроэндокринное новообразование возникает в бронхиальной системе.
В 7% случаев НЭО поражают поджелудочную железу. В данной ситуации применяется термин «опухоли островковых клеток».
Феохромоцитома — опухоль надпочечников (иногда в других частях тела), которая вырабатывает гормоны стресса: адреналин и норадреналин. В результате избыточного уровня гормонов возникают приступы (кризы), во время которых человек испытывает беспокойство, страх, озноб, дрожь, головную боль и боль в грудной клетке, его кожа становится бледной, учащается сердцебиение, возникают экстрасистолы, тошнота, рвота.
Рак из клеток Меркеля — злокачественная опухоль кожи. Она встречается очень редко, но отличается высокой агрессивностью, рано распространяется в лимфатические узлы, метастазирует. Патология проявляется в виде одного или нескольких узелков на коже красного и синюшного цвета. Они могут изъязвляться. Рак из клеток Меркеля сложно диагностировать, зачастую его выявляют уже на поздних стадиях.
Симтомы болезни
Функциональные опухоли приводят к синдромам гормональной гиперсекреции.
| Неоплазия | Симптом (ы) |
| Инсулинома | Гипогликемия — снижение уровня глюкозы в крови. Потливость, слабость, тремор, чувство голода и т.д. |
| Гастринома (ульцерогенная аденома поджелудочной железы) | Проявляется как затяжная язвенная болезнь желудка, плохо поддающаяся лечению — боли в животе, тошнота, рвота и т.д. |
| VIPома | Неукротимый понос, снижение уровня калия в крови, снижение кислотности желудочного сока, обезвоживание, похудение. |
| Глюкагонома | Непереносимость глюкозы, дерматит, стоматит, глоссит, тромбоз глубоких вен, депрессия, сердечная недостаточность. |
| Соматостатинома | Симптомы сахарного диабета и желчнокаменной болезни, стеаторея, ахлоргидрия. |
Нефункциональные новообразования вызывают неспецифические симптомы, такие как неопределенная боль в животе, и обычно выявляются случайно.
Различия между функциональными и нефункциональными ПНЭН основано на клинических проявлениях, и нет абсолютной разницы в выражении гормонов между функциональными и нефункциональными ПНЭН.
Например, опухолевые клетки в небольшом ПНЭН могут экспрессировать глюкагон, что приводит к пограничному повышению уровней глюкагона. Клинически, однако, эта ПНЭН определяется как нефункциональная, потому что небольшого повышения глюкагона недостаточно, чтобы вызвать синдром глюкагономы.
Классификация нейроэндокринных опухолей
Существуют разные классификации нейроэндокринных опухолей. Ниже в таблице представлены основные группы:
| В зависимости от того, производит ли опухоль гормоны |
|
| В зависимости от локализации |
|
| В зависимости от степени дифференцировки — насколько сильно опухолевая ткань отличается от нормальной. |
|
| Опухоли поджелудочной железы, которые производят определенные гормоны |
|
Стадию нейроэндокринных опухолей определяют в соответствии с общепринятой системой TNM:
- T — размер первичной опухоли, ее прорастание в окружающие ткани.
- N — поражение регионарных (близлежащих по отношению к опухоли) лимфатических узлов.
- M — наличие отдаленных метастазов.
Классификация по стадиям различается в зависимости от того, в каком органе находится нейроэндокринное новообразование. Например, стадию опухоли APUD-системы в легком определяют так же, как для немелкоклеточного рака легкого. Для нейроэндокринных новообразований в желудке, тонкой кишке, червеобразном отростке, ободочной, прямой кишке и поджелудочной железе разработаны собственные системы классификации по стадиям.
Диагностика
Поскольку для распознавания синдрома гормональной гиперсекреции требуется значительный клинический опыт, а симптомы нефункциональных опухолей неспецифические, диагностика ПНЭН часто происходит довольно поздно.
Эндокринное тестирование, визуализация и гистологические данные необходимы для точной диагностики ПНЭН.
Полная диагностика должна установить природу ПНЭН, оценить степень опухоли, определить первичные и метастатические очаги и определить, функционирует ли опухоль. Если подозревается синдром гормональной гиперсекреции, проводится соответствующее биохимическое исследование для его определения, а затем уже визуализация, эндоскопия и биопсия.
Если опухоль в поджелудочной железе или печени случайно идентифицируются с помощью визуализации, они обычно подвергаются биопсии для подтверждения наличия ПНЭН. Биохимическое тестирование в идеале проводится, даже если синдром гормональной гиперсекреции не очевиден, поскольку он может быть на субклинической стадии, а гиперсекретированные гормоны могут использоваться в качестве маркеров опухоли во время последующих оценок.
Прогноз выживаемости
Прогноз зависит от того, какой вид опухоли был диагностирован, насколько она агрессивна, на какой стадии находится. Лечение преследует одну из двух целей:
- Полностью удалить опухолевые очаги. Если по результатам обследований не выявляются признаки присутствия опухоли в организме, констатируют ремиссию.
- Избавить пациента от симптомов и сдержать рост новообразования. При этом больной может прожить довольно долго.
Стоит поговорить с врачом перед началом лечения, спросить, какой будет цель, какого результата можно ожидать, и что планируется делать в случае, если ситуация ухудшится, опухоль рецидивирует.
Запись на консультацию круглосуточно
+7+7+78
Лечение
Лечение у пациентов с нейроэндокринными новообразованиями поджелудочной железы проводят индивидуально, чтобы сбалансировать эффекты гиперсекреции гормонов. Многие эндокринные опухолевые синдромы поджелудочной железы потенциально опасны для жизни. Поэтому, первоначальная медикаментозная терапия направлена на стабилизацию состояния пациента, чтобы обеспечить полную предоперационную оценку.
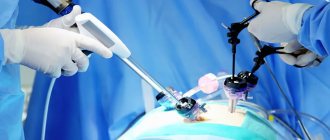
Все резектабельные функциональные или нефункциональные ПНЭН рекомендуется лечить хирургическим путем. Используются разные типы оперативного вмешательства:
- энуклеация опухоли (удаление видимой части новообразования с сохранением здоровой ткани органа);
- энуклеация в сочетании с резекцией ПЖ;
- дистальная резекция поджелудочной железы;
- панкреатодуоденэктомия (удаление ПЖ и части кишечника);
- и т.д.
Тип хирургического вмешательства определяется индивидуально, исходя из особенностей конкретного заболевания у конкретного пациента. В то же время нейроэндокринный рак поджелудочной железы требует обязательного иссечения лимфатических узлов.
Все резектабельные инсулиномы должны быть удалены хирургическим путем, несмотря на размер опухоли. 85–90% пациентов с этим типом ПНЭН могут быть вылечены полностью таким способом. Инсулиномы составляют примерно 35–40% функциональных ПНЭН. Из них злокачественные инсулиномы составляют только около 5–10% от общего количества.
Системная терапия необходима пациентам с остаточным заболеванием после операции и для лечения неоперабельных опухолей.
Против функциональных ПНЭН эффективны синтетические аналоги гормона соматостатина (гормон роста). Особенно хорошо выражено их действие при VIPомах и глюкагономах.
Нет четких доказательств того, что аналоги соматостатина лечат нефункциональные ПНЭН, но, скорее всего, они способны сдерживать рост опухоли.
В настоящее время доступны два аналога соматостатина, октреотид и ланреотид, и их формы пролонгированного действия, а новый аналог, пасиреотид, пока находится в фазе клинических испытаний с обнадеживающими предварительными результатами.
Прогрессивные методы лечения нейроэндокринных панкреатических неоплазий в Бельгии
В клиниках Бельгии используются при лечении ПНЭН современные методы малоинвазивной хирургии, лучевой терапии, биологической терапии и химиотерапии.
В числе микроинвазивных хирургических и радиологических методов:
- радиоактивные полимерные микросферы;
- химиоэмболизация;
- мягкая эмболизация;
- радиочастотная абляция (RFA);
- чрескожная алкогольная абляция;
- микроволновая абляция.
Системный интерферон-α2A применяется в клиниках Бельгии для лечения ПНЭН, которые нечувствительны к аналогам соматостатина.
Ингибитор mTOR эверолимус (RAD001) и ингибитор тирозинкиназы сунитиниб эффективно используются в бельгийских клиниках для замедления прогрессирования неоплазий.
Химиотерапия доступна для неоплазий среднего и высокого уровня злокачественности. Темозоломид и капецитабин — препараты выбора, которые могут применяться у пациентов с быстро прогрессирующими ПНЭН.
Успешно внедряется в практику и разработанный Бельгийскими учеными в сотрудничестве с коллегами из Нидерландов метод Радионуклидной терапии пептидными рецепторами (PRRT) Lutetium Lu 177-dota-tate. Он эффективен против хорошо дифференцированных ПНЭН. Но этот метод пока не получил широкого распространения, поэтому она лучше всего подходит для неоплазий с большим потенциалом злокачественности, которые устойчивы к другим системным методам лечения
Осложнения
У пациентов с эндокринными неоплазиями поджелудочной железы может наблюдаться заболеваемость, связанная с ростом опухоли.
- Пациенты с опухолями в головке поджелудочной железы иногда имеют закупорку желчных путей, закупорку поджелудочной железы или и то, и другое.
- Хроническая боль в животе может возникать из-за сжимающего воздействия большой внутрибрюшной опухоли или обструктивного панкреатита.
Заболеваемость, вызванная эффектами избыточной гормональной продукции функциональными новообразованиями поджелудочной железы, наступает раньше, чем опухолевые эффекты в ходе заболевания.
- При отсутствии лечения у пациентов с инсулиномой могут наблюдаться гипогликемические судороги и даже открытая кома.
- До разработки эффективных антисекреторных препаратов (например, Н2-блокаторов и ингибиторов протонной помпы) у пациентов с гастриномой часто было опасное для жизни желудочно-кишечное кровотечение при язвенной болезни.
- Пациенты с VIPомами рискуют быть обезвожены от диареи. У них также могут развиться фатальные сердечные аритмии могут ввиду связанной гипокалиемии.
- Заболеваемость, связанная с гормональными эффектами глюкагономы, может быть полиморфной. У пациентов может быть диабет, истощение, стоматит и другие признаки, сходные с тяжелым дефицитом питательных веществ.
Прогноз
Прогноз при большинстве типов ПНЭН — благоприятный. Но даже та нейроэндокринная опухоль поджелудочной железы, прогноз при которой считается хорошим, требует постоянного наблюдения. Поскольку усиление скорости роста может стать тревожным фактором, ухудшающим выживаемость.
Поскольку эти опухоли обычно растут медленно и имеют относительно низкий метастатический потенциал, а также потому, что не было определено каких-либо конкретных критериев для прогнозирования их поведения, различия между доброкачественными и злокачественными новообразованиями основано на наличии метастатического заболевания.
Пятилетняя выживаемость при ПНЭН без проведения лечения составляет:
- 80% для всех стадий;
- 90–100% для локализованной болезни;
- 40% для регионарной болезни;
- 29% для отдаленных метастазов.
Долгосрочная специфическая выживаемость (DSS) хирургически резецированных опухолей превышает 50% через 20 лет.
Поскольку даже метастатические эндокринные новообразования поджелудочной железы обычно растут медленно, прогноз у пациентов с этими опухолями является относительно хорошим по сравнению с таковым у пациентов с неэндокринным раком.
Более 90% пациентов с инсулиномами имеют доброкачественные новообразования без признаков метастазов, и до 97% этих пациентов полностью излечиваются хирургической резекцией.
Пациенты с гастриномами имеют худший прогноз. 60% этих опухолей злокачественные. Тем не менее, показатели выживаемости разительно отличаются между пациентами, у которых метастазирование гастриномы ограничено лимфатическими узлами, и пациентами с метастазами в печень, следующим образом:
- пациенты, у которых метастазирование гастриномы включает только лимфатические узлы, могут проживать 25 лет или дольше, и их продолжительность жизни неотличима от таковой у людей без гастриномы.
- пациенты с метастазами в печени имеют 5-летнюю выживаемость 20-30%, по сравнению с 90% у пациентов без метастазов в печени.
Приблизительно половина всех VIPом имеют метастазы на момент постановки диагноза или операции и примерно треть пациентов полностью излечивается хирургическим путем.
Большинство соматостатином (84%) уже метастазируют на момент презентации, но ряд пациентов выживают через 5 лет после комбинированной операции и химиотерапии.
Среди эндокринных неоплазий глюкагономы имеют тенденцию быть относительно большими (5-10 см) при постановке диагноза. Кроме того, до 80% таких неоплазий показывают инвазивный или метастатический рост. Синдром глюкагономы у большинства пациентов распознается относительно поздно, и хирургическое лечение возможно менее чем у 20% всех пациентов. В связи с этим такая нейроэндокринная опухоль поджелудочной имеет самый серьезный прогноз.
Молекулярные подтипы нейроэндокринного рака поджелудочной железы
Современные молекулярно-генетические методы позволяют изучить опухоли на уровне транскриптома, и нередко в результате оказывается, что один вид злокачественного новообразования по своим молекулярным характеристикам может быть разделен на несколько. Это и случилось в недавнем исследовании английских и итальянских ученых, которые провели секвенирование транскриптомов биоптатов нейроэндокринного рака поджелудочной железы [1]. В результате были выявлены 4 молекулярных подтипа, отличавшиеся друг от друга, в первую очередь, активностью определенных генов (рис. 2).
Рисунок 2. Тепловая карта, отображающая уровни экспрессии «иммунных» генов (справа), и диаграмма, отображающая процентное соотношение количества экспрессируемых иммунных генов (слева) в четырех подтипах нейроэндокринных опухолей поджелудочной железы. Самый богатый иммунными генами подтип — метастазоподобная первичная опухоль-1.
[1]
Клетки иммунной системы (лейкоциты) мигрируют в нейроэндокринную опухоль, инфильтрируют ее и экспрессируют гены, связанные с иммунитетом.
Самый «иммунный» из всех молекулярных подтипов нейроэндокринных опухолей ПЖ — это метастазоподобная первичная опухоль-1 (metastasis-like primary tumour-1, MLP-1). Встречающиеся в ней иммуноциты экспрессируют 56% иммунных генов (рис. 2), которые ученые разделили на две группы (рис. 3):
Первая группа — гены, кодирующие активированные Т-лимфоциты и белки-цитокины (интерфероны, интерлейкины, стимуляторы интерферонов).
Вторая группа — гены моноцитов/макрофагов и дендритных клеток, необходимые для процессинга (переработки) антигенов.
Рисунок 3. Тепловая карта, отображающая уровни экспрессии 19 идентифицированных иммунных генов в нейроэндокринных опухолях поджелудочной железы. Верхняя полоса указывает на подтип. На радужной шкале под тепловой картой красный цвет (+1 балл) означает высокий уровень экспрессии иммунных генов, синий (–1 балл) — низкий, белый (0 баллов) — отсутствие экспрессии генов. В подтипе MLP-1 наиболее ярко выражена экспрессия генов LAG3, IFI16, SPP1, CCRL2, TREM2, ANXA1.
[1]
В ходе гистологического исследования выяснилось, что опухоль MLP-1 менее васкуляризирована (обеднена кровеносными сосудами) по сравнению с другими подтипами нейроэндокринных опухолей поджелудочной железы. Следовательно, она подвержена гипоксии, что в свою очередь стимулирует запрограммированную некротическую гибель клетки — некроптоз . В отличие от апоптоза некроптоз сопровождается сильным иммунным ответом: погибающая клетка высвобождает ассоциированные с повреждениями молекулярные паттерны (образы патогенности, ассоциированные с повреждениями — damage-associated molecular patterns, DAMP), которые активируют каскад иммунных реакций, особенно секрецию цитокинов (интерферонов I и II типов и интерлейкина 18 (IL-18)), имитируя иммунный ответ на вирусную инфекцию (вирусная мимикрия). В итоге, в условиях гипоксии усиливается некроптоз опухолевых клеток, количество DAMP-молекул увеличивается, и усиливается иммунная реакция.
Некроптоз — запрограммированная некротическая гибель клетки, запускаемая через рецепторы смерти (например, через рецептор фактора некроза опухоли) и имеющая, в отличие от некроза, четкую систему регуляции: регулируется протеинкиназами — ферментами, которые модифицируют белки. При некроптозе так же, как и при апоптозе происходит образование активных форм кислорода в митохондриях, но не происходит фрагментации ДНК.
В поисках ответа на вопрос, почему так происходит, исследователи обнаружили, что в организме больных нейроэндокринным раком поджелудочной железы дендритные клетки (клетки, которые знакомят «наивные» Т-лимфоциты с антигенами) интенсивно синтезируют toll-подобный рецептор 3 (TLR3), лигандом которого является двуцепочечная РНК, появляющаяся при некроптозе. Кроме того, увеличивается количество дендритных клеток (рис. 4), следовательно, повышается уровень экспрессии TLR3, и это стимулирует синтез белков DAMP.
Рисунок 4. Диаграмма, отображающая количество дендритных клеток в четырех различных молекулярных подтипах нейроэндокринных опухолей поджелудочной железы
[1]
Исходя из того, что некроптоз является некротической гибелью клеток, для успешного лечения следует исключить те условия, в которых это будет происходить. Опухоль — это живой орган, который питается кислородом. Недостаток кровоснабжения (ишемия) ведет к гипоксии, которая и является условием для возникновения и усиления некроптоза. Клетки опухоли (в том числе и нейроэндокринной) обладают уникальной способностью способствовать появлению новых сосудов (ангиогенезу). Однако такие сосуды дефектны, они не выполняют свою функцию должным образом, вследствие чего опухолевые клетки испытывают стресс. Далее вступает в игру естественный отбор: уязвимые клетки погибают, резистентные клетки мигрируют по сосудам в близлежащие лимфатические узлы, а также в отдаленные органы и ткани, формируя вторичные очаги опухоли — метастазы (клоны опухоли). Этот процесс называется метастазированием. Он является одной из главных стратегий выживания опухоли в организме. Стимуляция же кровотока в опухоли способствует ее интенсивному росту, что ухудшает прогноз. Однако это единственный способ избежать некроптоза, так как DAMP-молекулы вводят иммунную систему в заблуждение, вследствие чего она не может уничтожить опухоль. Замкнутый круг, верно?
В итоге, для того чтобы научиться лечить такие опухоли, нам необходимо более подробно исследовать механизмы ангиогенеза, проанализировать уровень цитокинов, генов, которые экспрессируют различные клетки микроокружения опухоли помимо иммуноцитов. Также можно выявить и новые белки-регуляторы некроптоза. Все это в перспективе поможет победить один из самых агрессивных видов рака.