Как подготовиться к УЗИ желудка?
Насколько достоверны результаты исследования, зависит от того, делают ли УЗИ желудка специалисты и от правильной подготовки к процедуре УЗИ желудка.
Требуется соблюдение диеты около двух дней перед процедурой.
Нельзя: продукты, провоцирующие газообразование (ржаной хлеб, горох, фасоль, капуста, кефир, газированная минералка, свежие фрукты и овощи).
- Часто возникают вопросы перед УЗИ: делают на голодный желудок или нет, можно ли кушать перед УЗИ желудка. Последний прием пищи в день, предшествующий исследованию, не позднее семи-восьми часов вечера.
- Утром в день УЗИ желудка и кишечника не есть, не пить и не курить.
- Пациентам с сильными голодными болями разрешается выпить полстакана чая и съесть сухарик.
Как проходит процедура?
Исследование безболезненно, не предполагает нарушения целостности кожных покровов. Существуют разные методики его проведения.
Трансабдоминальные методы исследования
Трансабдоминальный метод УЗИ – это ультразвуковое исследование, которое проводится с использованием поверхностного датчика.
Осмотр проводится через все слои брюшной стенки.
- Пациент в кабинете ультразвуковой диагностики должен оголить переднюю брюшную стенку.
- После этого пациент занимает удобное положение на кушетке.
- На живот наносится специальный гель.
- Во время процедуры врач может попросить повернуться на бок или живот, чтобы осмотреть органы с лучшей проекции.
- Врач может показывать пациенту ход обследования на мониторе.
- Если подготовка к трансабдоминальному УЗИ проводилась нормально, то процедура длится около получаса.
Этот способ диагностики является наиболее распространенным, так как он полностью безболезненный, а в процессе исследования датчик не вводится в организм.
Эндоскопическое УЗИ
Эндосонография представляет собой сочетание ультразвукового обследования внутренних органов и эндоскопии, позволяющей подвести УЗ-датчик непосредственно к обследуемому органу.
Данный способ используется, когда необходимые данные не могут быть получены трансабдоминальным УЗИ.
- Человек ложится на левый бок и немного сгибает ноги в коленях.
- Эндоскоп аккуратно вводится через полость рта или через носовую полость в просвет глотки и пищевода, что позволяет лечащему врачу обследовать расположенные рядом легкие и лимфатические узлы с помощью ультразвукового датчика.
- Продвигая эндоскоп дальше в желудок, врач может оценить состояние его стенок, а также расположенную рядом селезенку и поджелудочную железу.
- При проведении датчика в двенадцатиперстную кишку оценивается проходимость и состояние желчевыводящих протоков и головки поджелудочной железы, где очень часто локализуется опухолевый процесс.
Исследование выполняется с использованием медикаментозного сна или же на фоне приема успокаивающих медикаментов. В частности, медикаментозный сон необходим при проведении биопсии подозрительных образований или же при выполнении исследования через толстую кишку.
Процедура может занимать от 20 минут до 2 часов, это зависит от цели обследования, а также от необходимости проведения дополнительной биопсии или хирургического вмешательства.
Растущее внимание к проблеме пищевода Баррета (ПБ) вызвано высокой частотой развития аденокарциномы пищевода (АП) — злокачественной опухоли пищевода, которая развивается из метаплазированного кишечного эпителия слизистой оболочки при ПБ либо (крайне редко) из эзофагеальных желез (тип I по классификации J. Siewert). За последние десятилетия произошли значительные изменения в показателях заболеваемости АП и плоскоклеточным раком пищевода. Теперь в большинстве случаев рака пищевода в странах Западной Европы и США выявляется именно АП. В США частота встречаемости АП увеличилась почти на 300% за последние 30 лет (рис. 1)
Рис. 1. Рост заболеваемости аденокарциномой пищевода в США и снижение заболеваемости плоскоклеточным раком (1975—2000 гг.) [3]. [1, 2].
В России такая тенденция прослеживается не столь отчетливо: 7—20% диагностированных раков пищевода имеют гистологические признаки аденокарциномы. Однако оценить достоверность и точность таких данных сложно: заболевание выявляется на поздних стадиях распространенного рака, когда невозможно определить, где образовалась опухоль — в дистальном отделе пищевода или в проксимальном отделе желудка. Среди всей онкопатологии органов пищеварительной системы рак пищевода и рак желудка имеют наибольшие показатели смертности. Прогноз после постановки диагноза аденокарциномы неблагоприятный — 5-летняя выживаемость не превышает 10—20%, а совершенствование методик хирургического лечения вносит не столь значительный вклад в улучшение этих показателей [4].
Понимание причин возникновения АП и предраковой патологии, возможности раннего выявления предопухолевых процессов и ранних форм опухоли значительно улучшились в последнее время. Это позволяет формировать группы повышенного риска АП, организовывать экспертные центры для выявления и своевременного лечения предопухолевой патологии. По мнению авторитетных экспертов, аденокарцинома пищеварительного тракта наиболее часто развивается в патологически измененной слизистой оболочке. Хронический воспалительный процесс рассматривается как одно из важных звеньев в цепи процессов, приводящих в конечном итоге к АП [5,6]. Определены и основные заболевания, на фоне которых рак развивается достоверно чаще. Для А.П. фоновым заболеванием в большинстве случаев является ПБ.
Скрининг
Риск развития АП у пациентов с ПБ во многом зависит от наличия кишечной метаплазии, диспластических изменений эпителия и степени их выраженности в дистальном отделе пищевода (в сегменте цилиндроклеточной метаплазии дистального отдела пищевода). На основании данных наблюдения за 8522 пациентами, включенными в канцеррегистр Северной Ирландии (средние сроки наблюдения составили 7 лет), при наличии кишечной метаплазии с бокаловидными клетками риск развития аденокарциномы увеличивается с 0,04 до 0,23% в год, а при наличии дисплазии эпителия низкой степени в сегменте метаплазии — риск увеличивается более чем в 9 раз. Совокупный риск развития аденокарциномы и дисплазии эпителия высокой степени также значительно выше в группах пациентов, у которых на момент включения в регистр были морфологические изменения, характеризующиеся кишечной метаплазией и дисплазией низкой степени (табл. 1)
Таблица 1. Риск аденокарциномы пищевода у пациентов с пищеводом Баррета при наличии кишечной метаплазии и дисплазии [7].
Риск развития АП на фоне ПБ является еще более значимым у пациентов с дисплазией эпителия в зоне сегмента цилиндроклеточной метаплазии и особенно дисплазии высокой степени (рис. 2).
Рис. 2. Риск развития рака у пациентов с сегментом цилиндроклеточной метаплазии без кишечного эпителия, с пищеводом Баррета без дисплазии и с дисплазией эпителия слизистой оболочки низкой и высокой степени [8—11].
Однако появлению АП предшествует постепенное прогрессирование диспластических изменений с потерей клетками признаков дифференцировки. Прогрессирование от легкой дисплазии (дисплазия низкой степени) к тяжелой (дисплазия высокой степени) в среднем может протекать в течение 29 мес, тогда как последующее развитие аденокарциномы занимает в 2 раза меньший интервал времени — 14 мес [7]. Широкое распространение ГЭРБ и определение каскада предраковых событий являются потенциально привлекательной целью для проведения скрининга ПБ и А.П. Одни из последних американских рекомендаций (American college of gastroenterology) предполагают, что проведение эндоскопического исследования верхних отделов пищеварительного тракта необходимо всем пациентам, имеющим симптомы хронической ГЭРБ, в связи с высоким риском у них ПБ [12]. Европейским обществом гастроинтестинальной эндоскопии отмечено, что в настоящее время проведение скрининга целесообразно только в группах высокого риска развития аденокарциномы: при наличии длительного анамнеза ГЭРБ (более 5 лет), при сочетании таких факторов риска как возраст пациента более 50 лет, мужской пол, наличие кровных родственников, у которых была выявлена АП или ПБ, высокий индекс массы тела и другие факторы [13]. Среди всех методов скрининга эндоскопическое исследование верхних отделов пищеварительного тракта является «золотым стандартом» в диагностике патологических процессов слизистой оболочки пищевода, так как позволяет не только визуально определить наличие цилиндрического эпителия в пищеводе, но и выполнить биопсию для морфологического подтверждения диагноза, диагностики дисплазии и раннего рака. Это позволяет считать эндоскопический метод наиболее важным инструментом скрининга ПБ и АП.
Определение
Длительное время общепринятым в клинической практике было следующее определение ПБ: это патологическое состояние, при котором часть плоского эпителия слизистой оболочки дистальных отделов пищевода замещена метапластическим цилиндрическим эпителием. Сегмент цилиндрической метаплазии должен определяться при эндоскопическом исследовании, находиться выше зоны пищеводно-желудочного перехода или соединения (Z-линии) и подтверждаться морфологически путем обнаружения специализированной кишечной метаплазии (рис. 3)
Рис. 3. Пищевод Баррета. а — эндоскопическая картина при осмотре в белом свете; б — эндоскопическая картина при осмотре в узкоспектральном режиме (Narrow Band Imaging, NBI); в — гистологическая картина цилиндроклеточной метаплазии с диффузной кишечной метаплазией с множеством бокаловидных клеток — окраска гематоксилином и эозином, ×100; г — окраска альциановым синим, ×100. [14]. В 2021 г. Европейским обществом гастроинтестинальной эндоскопии (ESGE) было предложено более современное определение ПБ: это сегмент цилиндрического метапластического эпителия дистального отдела пищевода, длиной не менее 1 см, который может быть диагностирован при эндоскопическом исследовании проксимальнее зоны пищеводно-желудочного соединения и подтвержден гистологически наличием в биопсийном материале специализированной кишечной метаплазии [15].
В соответствии с рекомендациями Российской гастроэнтерологической ассоциации (РГА) в настоящий момент для установления диагноза «пищевод Баррета» требуется обязательное гистологическое подтверждение метаплазии эпителия слизистой оболочки пищевода по кишечному типу, так как это единственный тип цилиндрического эпителия, отличающийся повышенным потенциалом малигнизации [16].
Из этого определения следует, что эндоскопическое и морфологическое исследования лежат в основе правильной диагностики этого патологического состояния. От врача-эндоскописта, его знаний, методических навыков, правильности интерпретации выявленных изменений слизистой оболочки, опыта и, наконец, технического оснащения зависит своевременная и отвечающая современным критериям диагностика ПБ, диспластических изменений слизистой оболочки и ранних форм А.П. Однако кишечная метаплазия не всегда является зоной роста АП, в связи с чем в Японии для установления диагноза ПБ необходимо только обнаружить сегмент цилиндроклеточной метаплазии в дистальном отделе пищевода при эндоскопическом исследовании.
Распространенность гастроэзофагеальной рефлюксной болезни и цилиндроклеточной метаплазии в дистальном отделе пищевода
ПБ является одним из наиболее серьезных осложнений ГЭРБ — хронического рецидивирующего заболевания, обусловленного спонтанным, регулярно повторяющимся ретроградным поступлением в пищевод желудочного и/или дуоденального содержимого, приводящего к повреждению дистального отдела пищевода и/или появлению характерных симптомов (изжога, ретростернальные боли, дисфагия). Как самостоятельная нозологическая единица ГЭРБ официально получила признание в материалах по диагностике и лечению этого заболевания, принятых в октябре 1997 г. на Междисциплинарном конгрессе гастроэнтерологов и эндоскопистов в г. Генвале (Бельгия) [17]. Результаты исследований, проведенных в мире и охватывающих большие группы населения, показывают, что симптомы ГЭРБ испытывают более 1/3 населения, а наличие ежедневной изжоги — 7—10%. Осложнения рефлюксной болезни и изжога (основной симптом ГЭРБ) гораздо чаще наблюдаются у представителей белой расы (12,3 и 34,6% соответственно) и черной расы (2,8 и 46,1% соответственно) по сравнению с жителями Восточной Азии (0 и 2,6% соответственно [18]. Оценить распространенность цилиндроклеточной метаплазии в дистальном отделе пищевода достаточно сложно, так как более 80% случаев заболевания остаются не диагностированными, что отображают данные американского исследования материала аутопсий [19]. Результаты исследования, проведенного в США этой же группой специалистов (A. Cameron и соавт.), показывают 28-кратное увеличение числа клинически диагностированных случаев метапластических изменений в дистальном отделе пищевода за период с 1965 по 1995 г. Данные эндоскопического обследования верхних отделов пищеварительного тракта у пациентов, поступивших в клиники с симптомами диспепсии или по поводу проведения колоноскопии, свидетельствуют о различиях в преобладании цилиндроклеточной метаплазии пищевода в зависимости от этнических и географических факторов (табл. 2).
Таблица 2. Частота обнаружения пищевода Баррета при эндоскопическом исследовании верхних отделов пищеварительного тракта у пациентов с диспепсией
Распространенность ГЭРБ в России среди взрослого населения составляет около 40%, а у 45—80% из них обнаруживается эзофагит: в 10—35% случаев это тяжелый эзофагит с множественными эрозивными поражениями слизистой оболочки дистального отдела пищевода. ПБ различной степени протяженности диагностируют в среднем у 8—15% пациентов с эзофагитом. АП развивается у 0,5% пациентов с ПБ в год при низкой степени дисплазии, у 6% в год — при дисплазии эпителия высокой степени [26]. К факторам риска ПБ относятся средний и пожилой возраст, мужской пол. У большинства пациентов эту патологию диагностируют в возрасте 50—60 лет, у мужчин в 3—4 раза чаще, чем у женщин.
Патогенез
Одной из основных причин развития ГЭРБ и ПБ является гастроэзофагеальный рефлюкс — заброс (попадание) желудочного содержимого (в первую очередь соляной кислоты) в пищевод. При развитии такого рефлюкса рН в дистальном отделе пищевода значительно смещается в сторону низких значений за счет попадания кислого содержимого желудка. Продолжительный контакт слизистой оболочки пищевода с кислым рефлюксатом, кроме того, содержащим пепсин, способствует развитию ее воспаления. Желчные кислоты и ферменты, которые также могут входить в состав рефлюксата, при нарушении моторики верхних отделов пищеварительного тракта способны оказывать сильное повреждающее воздействие на слизистую пищевода. Эзофагит в ряде случаев сопровождается структурной перестройкой эпителия слизистой оболочки пищевода с формированием желудочной или кишечной метаплазии, которая и является фоном для развития аденокарциномы. Анализ многочисленных исследований показывает, что риск развития рака в сегменте цилиндроклеточной метаплазии связан в первую очередь с наличием кишечной метаплазии (неполной кишечной метаплазии, тип II и III) [27, 28]. В пищеводе метапластические изменения начинаются с появления сначала цилиндрического эпителия желудочного типа, а затем эпителия толстокишечного типа. Экспозиция кислоты в пищеводе увеличивает, с одной стороны, активность протеинкиназ, инициирующих митогенную активность клеток, и, соответственно, их пролиферацию, и, с другой стороны, угнетает апоптоз в пораженных участках слизистой оболочки. Примерно 50—80% случаев дисплазии на фоне ПБ и АП характеризуются мутациями генов, участвующих в регуляции клеточного цикла, репарации ДНК и апоптозе [20]. Последние исследования в этой области свидетельствуют о важной роли генов (белков) Р53 и Р63, участвующих в развитии клеток плоского эпителия. В пищеводе экспрессия белка Р63 определяется только в клетках плоского эпителия и отсутствует в цилиндроклеточной метаплазии. При отсутствии Р63 стволовые клетки слизистой оболочки не могут начать дифференцировку по пути клеток плоского эпителия, в результате такого нарушения образуются клетки цилиндрического эпителия [29, 30]. Основой для происхождения клеток эпителия кишечного типа может служить как сам многослойный плоский и кубический эпителий протоков желез подслизистого слоя пищевода, так и эпителий кардиального типа в дистальном отделе пищевода, подверженные воздействию рефлюксата [31, 32]. Среди факторов, влияющих на процессы канцерогенеза в области пищеводно-желудочного соединения, необходимо учитывать также курение, алкоголь, повышенную массу тела и рефлюкс желчи. Динамические наблюдения за пациентами с ПБ показали, что развитие аденокарциномы происходит через многоступенчатый патологический процесс. Этот процесс характеризуется нарастанием степени дисплазии — патологии, предшествующей аденокарциноме. Важным промотором этого процесса является оксид азота, который может накапливаться в патологически измененных тканях дистального отдела пищевода и вызывать генетические изменения. Генетические изменения в клетках происходят параллельно переходу метаплазии в дисплазию и затем в аденокарциному [33].
Диагностика и скрининг пищевода Баррета и аденокарциномы пищевода
Эндоскопическое исследование является ключевым при диагностировании ПБ: тогда как остальные методы (рентген, сцинтиграфия) могут лишь предположить этот диагноз, эндоскопический метод может с высокой степенью вероятности установить его. При эндоскопическом исследовании определяется протяженность изменения слизистой оболочки, отношение зоны изменений слизистой оболочки по протяжению к пищеводно-желудочному переходу, а также проксимальная граница по отношению к резцам. При этом распространение зоны метаплазии хорошо визуализируется в виде очагов гиперемии («языки пламени») на фоне «жемчужно-белого» эпителия пищевода. Одной из важных задач эндоскопического исследования является получение биопсийного материала. Задачами же морфологического исследования являются подтверждение метаплазии слизистой оболочки пищевода, выявление участков дисплазии и фокусов аденокарциномы.
C позиции эндоскопии точная диагностика ПБ сопряжена с несколькими проблемами. Одна из них заключается в определении ключевых ориентиров — зоны пищеводно-желудочного соединения или перехода (ПЖС), Z-линии и границ сегмента цилиндроклеточной метаплазии. Другая — точность выполнения биопсии при очаговом распределении участков кишечной метаплазии и дисплазии в сегменте цилиндроклеточной метаплазии пищевода и трудности эндоскопической диагностики этих очагов [34].
Ключевые ориентиры эндоскопической диагностики
1. Зона пищеводно-желудочного соединения (перехода) — это область соединения мышечного слоя пищевода и мышечного слоя кардиального отдела желудка. Она соответствует границе между трубчатой структурой пищевода и проксимальной частью желудка с продольными складками. Эта анатомическая граница определяется в области проксимального края продольных складок слизистой оболочки желудка (рис. 4).
Рис. 4. Эндоскопическая картина пищевода Баррета. Стрелками указан проксимальный край складок слизистой оболочки желудка, соответствующий зоне пищеводно-желудочного соединения. Еще одним дополнительным ориентиром пищеводно-желудочного соединения служит дистальная граница видимых при эндоскопии продольных сосудов слизистой оболочки
(palisade or longitudinal intramucosal vessels)
. Эти сосуды были впервые описаны J. Carvalho в 1963 г. и представляют собой вены, расположенные в слизистой оболочке над собственной мышечной пластинкой. В желудке они расположены в подслизистом слое и выходят в поверхностные слои слизистой оболочки только в области границы желудка и пищевода. В слизистом слое пищевода они проходят в проксимальном направлении около 2 см параллельно друг другу в виде «частокола» и затем вновь погружаются в подслизистый слой, образуя более крупные вены. Японское общество изучения болезней пищевода рекомендует определять пищеводно-желудочное соединение именно по дистальному краю этих продольных сосудов (рис. 5)
Рис. 5. Продольные сосуды слизистой оболочки дистального отдела пищевода (осмотр в узкоспектральном режиме NBI). Стрелками указан дистальный край палисадных сосудов, соответствующий зоне пищеводно-желудочного соединения. [35].
2. Зубчатая линия или Z-линия
— граница между многослойным плоским эпителием пищевода бледно-розового цвета и более ярким и темным цилиндрическим эпителием желудка (см. рис. 3). Буква Z обозначает zero (ноль) — это нулевая отметка зоны, где заканчивается плоский эпителий пищевода [36]. В норме эта неровная линия совпадает с анатомической границей пищевода и желудка. При наличии цилиндроклеточной метаплазии в дистальном отделе пищевода Z-линия не совпадает с зоной пищеводно-желудочного соединения.
3. В том случае, когда Z-линия находится выше анатомической границы пищевода и желудка (ПЖС), определяется сегмент цилиндроклеточной метаплазии, расположенный между этими двумя ориентирами. Современная диагностика границ и протяженности сегмента цилиндроклеточной метаплазии дистального отдела пищевода основывается на Пражских критериях (The Barrett’s Prague C&M Criteria), разработанных Международной рабочей группой экспертов по классификации эзофагитов (The international working group for the classification of oesophagitis) на 12-й Европейской гастроэнтерологической неделе в Праге в 2004 г. Эти критерии предполагают определение проксимальной границы циркулярного сегмента метаплазии, а также определение максимальной протяженности и самой верхней границы наиболее длинного «языка» метаплазии, идущего от циркулярного сегмента до его верхнего края (значение М). Измерение протяженности циркулярного сегмента цилиндроклеточной метаплазии происходит от края желудочных складок (ПЖС) до его проксимального уровня (значение C) (рис. 6).
Рис. 6. Пражские критерии диагностики пищевода Баррета [37]. а — протяженность циркулярного сегмента метаплазии — 2 см, длина максимального по протяженности сегмента метаплазии — 5 см; эндоскопическое заключение — «Пищевод Баррета С—2, М—5»; б, в — эндоскопический пример правильного эндоскопического заключения после корректного определения пражских критериев пищевода Баррета — «Пищевод Баррета С—1, М—6». Мелкие островки метаплазии, расположенные проксимальнее общего сегмента, отдельно от него и несвязанные с ним, не учитываются.
Наличие у пациента аксиальной пищеводно-желудочной грыжи пищеводного отверстия диафрагмы (ПОД) существенно изменяет положение ключевых ориентиров диагностики П.Б. Поэтому диагностика этого патологического состояния также является важным элементом эндоскопического исследования и предполагает определение сужения, соответствующего ПОД, расположенному дистальнее зоны ПЖС [38].
Диагностика кишечного эпителия в сегменте цилиндроклеточной метаплазии
При гистологическом исследовании в зоне ПБ определяются три типа железистого эпителия: эпителий фундального отдела желудка (покровно-ямочный), эпителий кардиального отдела (или переходного типа) и специализированный (особый) кишечный эпителий с бокаловидными клетками [39]. Верификация П.Б. предполагает морфологическое подтверждение наличия специализированного, перестроенного по кишечному типу эпителия в дистальном сегменте пищевода. Если при гистологическом исследовании выявляются только клетки фундального или кардиального типов, следует говорить не о ПБ, а лишь о цилиндроклеточной метаплазии пищевода, не связанной с высоким риском возникновения А.П. До недавнего времени эндоскопическое исследование метаплазированного сегмента дистального отдела пищевода с выполнением так называемых «слепых» биопсий в четырех точках по окружности пищевода и на протяжении каждого сантиметра по длине сегмента являлось «золотым стандартом» диагностики П.Б. Однако результаты последних исследований показали, что точность такой диагностики очагов кишечной метаплазии составляет 48,2% [40].
Возможно ли повысить эффективность диагностики и динамического наблюдения за пациентами с ПБ с целью своевременного обнаружения не только специализированного кишечного эпителия, но и диспластических изменений эпителия, а также раннего рака?
В настоящее время актуальной является разработка новых и определение эффективности существующих методик окраски слизистой оболочки дистального отдела пищевода, позволяющих эффективно диагностировать метапластические, диспластические изменения, а также ранние формы рака. Кроме того, существует целый ряд новых оптических эндоскопических методик, позволяющих отказаться от выполнения «слепых» биопсий. Среди таких методик наиболее эффективными являются хромоэндоскопия, увеличительная и узкоспектральная эндоскопия.
Хромоэндоскопия
Методика окраски с метиленовым синим, основанная на поглощении красителя метаплазированным кишечным эпителием, эффективна в диагностике очагов кишечной метаплазии в сегменте цилиндроклеточной метаплазии дистального отдела пищевода. Именно эта методика позволяет объективно оценить локализацию, размеры и распространенность очагов кишечной метаплазии (рис. 7, а).
Рис. 7. Очаги кишечной метаплазии. а — после окраски 0,5% раствором метиленового синего имеют вид пятен синего цвета на фоне розового эпителия желудочного типа, который не поглощает краситель; б — ложноположительные результаты хромоскопии, краситель метиленовый синий адсорбируется в области линейных эрозий и язв. А методика окраски с индигокармином, позволяющая с помощью красителя выделять и подчеркивать структурные поверхностные изменения слизистой, помогает в диагностике очаговых поражений слизистой оболочки, в том числе и раннего рака. Выполнение прицельной биопсии окрашенных метиленовым синим участков с последующим морфологическим исследованием гастробиоптатов позволяет оценить тип кишечной метаплазии, своевременно диагностировать очаги дисплазии эпителия, встречающиеся на фоне метаплазии, и ранние формы рака. Однако методики хромоскопии не являются высокоспецифичными в отношении метапластических и диспластических изменений эпителия дистального отдела пищевода. Краситель метиленовый синий может прокрашивать не только очаги кишечной метаплазии, но и адсорбироваться в области эрозий и язв, что приводит к ложноположительным результатам диагностики (см. рис. 7, б).
Увеличительная эндоскопия
Увеличительная эндоскопия позволяет детально исследовать микроархитектонику слизистой оболочки сегмента цилиндроклеточной метаплазии пищевода с помощью оптического 115-кратного увеличения ее поверхности, определить типы рисунка, соответствующего метапластическим и диспластическим изменениям эпителия. Эта методика в сочетании с хромоскопией 0,5% метиленовым синим показала высокую специфичность и чувствительность не только в диагностике очагов кишечной метаплазии, но и диспластических изменений эпителия у пациентов с ПБ и позволила определить типы микроструктуры поверхности слизистой оболочки (рис. 8),
Рис. 8. Увеличительная эндоскопия (115-кратное оптическое увеличение) сегмента цилиндроклеточной метаплазии дистального отдела пищевода. Тип рисунка «продольных гребней» соответствует кишечному эпителию (пищевод Баррета). соответствующие этим патологическим изменениям [41].
Узкоспектральная эндоскопия
Узкоспектральная эндоскопия является одной из наиболее современных эндоскопических методик, зарегистрированных Минздравом России и разрешенных к применению в Р.Ф. Эндоскопическое исследование с функцией узкоспектрального изображения (narrow band imaging
) основано на использовании специальных узкоспектральных оптических фильтров, изменяющих спектр светового потока. Глубина проникновения светового потока зависит от длины волны, световые волны более длинного спектра (например, красный) более глубоко проникают в ткани, в то время как видимый синий спектр (более короткие волны) способен проникать только в поверхностные слои тканей, что позволяет более детально исследовать их микроструктуру. Таким образом, использование специальных узкоспектральных фильтров в этой системе, пропускающих световые потоки с длиной волны 415 и 445 нм и задерживающих световые волны, более глубоко проникающие в ткани, позволяет улучшить визуализацию поверхности слизистой оболочки. Кроме того, световые волны узкого спектра хорошо поглощаются гемоглобином тканей, что позволяет исследовать микрососудистый рисунок капилляров слизистой оболочки и подслизистого слоя пищевода. С помощью этой методики возможно не только повысить эффективность определения ключевых ориентиров диагностики ПБ (продольных сосудов), но и выявить мельчайшие нарушения архитектоники эпителия, характерные для метапластических, диспластических изменений и начальных форм рака (рис. 9).
Рис. 9. Пищевод Баррета. а — диагностика в обычном световом спектре; б — узкоспектральная эндоскопия с оптическим увеличением изображения — более четкая визуализация сегмента метаплазии дистального отдела пищевода с нарушением микроархитектоники и сосудистого рисунка, участками кишечного эпителия и дисплазии (указаны стрелкой).
С помощью увеличительной и узкоспектральной эндоскопии нами проведено исследование рисунка различных участков слизистой оболочки в сегменте цилиндроклеточной метаплазии дистального отдела пищевода, позволившее определить типы рисунка эпителия, не имеющего признаков дисплазии, а также структурных изменений, соответствующих дисплазии и раннему раку пищевода (рис. 10).
Рис. 10. Типы рисунка эпителия дистального отдела пищевода без неопластических изменений. а — овальный рисунок ямок — эпителий кардиального отдела желудка в дистальном сегменте пищевода; б — крупный и вытянутый овальный рисунок — «овальные гребни» — характеризует кишечную метаплазию; в — рисунок продольных гребней — кишечной метаплазии; г — патологические сосуды и разрушенный тип рисунка поверхности эпителия — дисплазия высокой степени. Полученные результаты и корреляция эндоскопических находок с данными гистологии показали высокую специфичность и чувствительность методик в диагностике типов эпителия дистального отдела пищевода [42]. Это позволяет говорить о новом направлении эндоскопического скрининга ПБ — «оптической биопсии» — и своевременном, высокоэффективном выявлении предраковых изменений и ранних форм рака [43].
Эндоскопическое исследование с использованием оптического увеличения изображения (более чем 100-кратного) в комбинации с узкоспектральным контрастным режимом осмотра позволяет провести точную диагностику патологических изменений эпителия, выявить участки желудочной и кишечной метаплазии и обнаружить патологические участки дисплазии и аденокарциномы. Специфичность и чувствительность методики в отношении метаплазии составляет 92 и 95% соответственно.
Лечение пациентов с пищеводом Баррета
Большинство пациентов с ПБ имеют симптомы, обусловленные рефлюксом желудочного содержимого в пищевод и характерные для ГЭРБ изжогу, регургитацию, загрудинные боли, а иногда и экстрапищеводные проявления (ларингит, хронический кашель и бронхиальная астма). Лечение пациентов с ПБ имеет два основных направления: терапия симптомов и проявлений ГЭРБ, а также снижение риска развития А.П. Современные принципы эффективной терапии любой формы ГЭРБ и, в частности, эрозивного эзофагита, отражены в рекомендациях Российской гастроэнтерологической ассоциации и состоят из двух основных этапов: индукции ремиссии и поддержании ремиссии эрозивного эзофагита. Первый этап лечения предполагает назначение ингибиторов протонной помпы (ИПП) в стандартных дозировках в течение 4 нед при единичных эрозиях и в течение 8 нед при множественных эрозивных поражениях слизистой оболочки. Поддерживающая терапия предполагает прием ИПП в половинной дозировке в течение 26—52 нед. ИПП создают оптимальные условия рН для заживления эрозий и снижения гиперпролиферации в метаплазированном эпителии. Такая тактика позволяет добиться быстрого улучшения клинической симптоматики, положительной динамики воспалительных изменений, определяемых при эндоскопии, сократить время и затраты на лечебный курс. ИПП являются основой как курсовой, так и поддерживающей терапии всех форм ГЭРБ и превосходят по суммарной клинической эффективности блокаторы H2-рецепторов гистамина в 2 раза, а прокинетиков — в 3 раза [44]. После длительного применения препаратов этой группы у пациентов с ПБ отмечается снижение маркеров пролиферации. И хотя считается, что ПБ, как правило, не подвергается обратному развитию, в ряде случаев удается добиться частичной регрессии ограниченного участка кишечной метаплазии. В одном из немногих рандомизированных исследований 68 пациентов с ПБ, получавших в течение 24 мес омепразол в дозе 40 мг (1-я группа) и ранитидин 150 мг (2-я группа) дважды в сутки, установлена небольшая, но статистически достоверная регрессия сегмента метаплазии. Уменьшение длины сегмента и его площади на 8% были зарегистрированы только в 1-й группе пациентов, получавших омепразол. Никаких изменений при приеме ранитидина отмечено не было [45].
Предотвращение прогрессирования метапластических изменений и неоплазии у пациентов с ПБ остается сложной и недостаточно изученной проблемой. В двух исследованиях было показано, что у 230 и 80 пациентов с ГЭРБ, получавших длительную терапию омепразолом в различных суточных дозах (от 20 до 80 мг), в процессе динамического наблюдения (в среднем 6,9 года) в 12 и 14,5% случаев соответственно были обнаружены метапластические изменения в дистальном отделе пищевода, характерные для ПБ [46, 47]. С другой стороны, результаты наблюдения за 350 пациентами с ПБ в среднем в течение 4,7 года показали, что риск диспластических изменений был в 5,6 раза выше у тех, кто не получал регулярную терапию ИПП (на протяжении как минимум 2 лет) в течение всего срока наблюдения [48]. Результаты работ в этой области в целом свидетельствуют о том, что терапия ИПП не может во всех случаях предотвратить метапластические и диспластические изменения в дистальном отделе пищевода у пациентов с ГЭРБ. Необходимы дальнейшие исследования в этой области, совершенствование механизмов регистрации мельчайших структурных изменений в слизистой оболочке, которое возможно при использовании новых оптических эндоскопических методик.
В случае неэффективности медикаментозной терапии, а также при выявлении диспластических изменений слизистой оболочки возможно применение хирургических и эндоскопических методик лечения. Ретроспективный анализ результатов хирургических операций — фундопликаций — не показал значимых преимуществ этой методики по сравнению с лекарственной терапией ИПП. Фундопликация не предотвращает ни появления ПБ у пациентов с ГЭРБ, ни его прогрессирования в АП [49]. Эндоскопические методики абляции и резекции метапластических и диспластических изменений у пациентов с ПБ являются альтернативой хирургической резекции, имеющей высокий риск развития осложнений (рис. 11)
Рис. 11. Этапы проведения эндоскопической аргоноплазменной абляции сегмента пищевода Баррета с обнаруженной и подтвержденной экспертом-морфологом дисплазией низкой степени без видимого патологического участка. а, б — диагностика пищевода Баррета при осмотре в стандартном белом световом режиме и с использованием узкоспектрального режима (NBI)
Рис. 11. Этапы проведения эндоскопической аргоноплазменной абляции сегмента пищевода Баррета с обнаруженной и подтвержденной экспертом-морфологом дисплазией низкой степени без видимого патологического участка. в—е — этапы выполнения гибридной аргоноплазменной абляции с использованием нового инструмента ЭРБЕ (Германия), первую в России операцию выполняет д-р Торстен Бейна (Дюссельдорф, Германия). [50, 51].
Эндоскопическое лечение должно сопровождаться адекватной антисекреторной терапией ИПП для обеспечения эффективного заживления дефектов слизистой оболочки в области удаленных очагов метаплазии или дисплазии и создания условий для появления в этих зонах многослойного плоского эпителия пищевода. Несмотря на высокую эффективность и относительную безопасность аргоноплазменной и электрокоагуляции, а также лазерной деструкции, эти методики абляции не всегда приводят к гистологической эрадикации кишечной метаплазии и не могут в 100% случаев предупредить последующее развитие диспластических изменений [52].
Алгоритм ведения пациентов с ПБ при наличии дисплазии эпителия определен в рекомендациях Европейского общества гастроинтестинальной эндоскопии. Основные положения алгоритма:
— профилактическая эндоскопическая терапия, такая как проведения абляции в случае наличия у пациента ПБ без дисплазии, не должна выполняться (ввиду крайне низкого риска развития аденокарциномы
Что показывает УЗИ желудка?
Что показывает УЗИ желудка у взрослых:
- наличие (или отсутствие) гастрита или язвы;
- злокачественную опухоль;
- сужение привратника, если оно выражено достаточно;
- непроходимость кишечника (для этого требуется ультразвуковое исследование ЖКТ целиком);
- любые аномальные явления в строении исследуемого органа.
Расшифровка результата
При проведении УЗИ желудка можно увидеть в норме следующее:
- орган в срезе обычно выглядит как овальное образование в форме кольца, имеющее ободок, характер которого – эхонегативный, а центр – эхопозитивный;
- стенки желудка в проксимальных отделах имеют толщину около 5 мм, а в пилорическом – около 7 мм;
- наличие 5 слоев в стенке желудка, различающихся по степени эхогенности;
- серозная оболочка, которая находится снаружи желудка, гиперэхогенна;
- оболочка из мышц гипоэхогенна, ее толщина – около 2,5 мм;
- оболочка подслизистой (со средней эхогенностью) имеет размеры около 3 мм;
- пластинка слизистой, состоящая из мышц, обычно низко гипоэхогенна, ее толщина не более 1 мм;
- слизистая имеет толщину около 1,5 мм, ее характер – гиперэхогенный;
- стакан выпитой пациентом жидкости выводится из желудка примерно за 1/3 часа, а первичный вывод жидкости в норме составляет около 180 сек.
Важна оценка не только толщины стенок желудка, но и то, насколько они равномерны.
Можно ли увидеть рак желудка на УЗИ?
На ранних стадиях рак желудка на УЗИ увидеть нельзя. Связано это с тем, что на таком этапе болезни изменения в желудке малозаметны и выявить их очень сложно.
На поздних стадиях изменения в организме уже достаточно обширны. УЗИ брюшной полости позволит судить о наличии метастазов и их размерах.
Однако чувствительность сканера ограничена, поэтому явные опухоли определяются только по достижении ими большого размера.
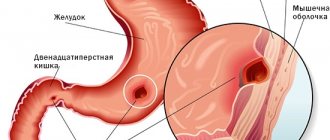
Можно ли увидеть язву желудка на УЗИ?
Видно ли на УЗИ язву желудка? Место, где язва, не будет отражать ультразвуковые волны. Заметив такую дыру, специалист поймёт, что у пациента язва. Однако такое показание на экране заболевания считается условным. Потребуется дополнительное обследование.
Патология пищевода на УЗИ
При поражении пищевода больной жалуется на затруднения глотания: «Пища где-то в груди останавливается, не проходит». Боль при проглатывании пищи встречается реже. Пищеводная рвота появляется через некоторое время после еды и тошнотой не сопровождается; рвотные массы выливаются без рвотных движений, состоят из принятой пищи с примесью слюны и слизи, иногда имеют гнилостный запах.
ГЭР и ГЭРБ на УЗИ
Гастроэзофагальный рефлюкс — заброс содержимого желудка в пищевод при расслабление НСП вне акта глотания. УЗИ проводят в положении пациента лежа на спине, можно опустить головной конец кушетки, тогда жидкость давит на пищеводно-желудочное соединение. На УЗИ нас интересует наружный диаметр пищевода, толщина стенки, длина брюшного отдела, угол Гиса. Подробнее смотри здесь.
ГЭР считают физиологичным, когда заброс происходит не более 50 раз в сутки, общей продолжительностью менее 60 минут, стенка пищевода не страдает. У младенцев из-за незрелости мышечного слоя и дна желудка частые забросы из желудка в глотку и ротовую полость при отхождении воздуха. Созревание происходит к 6-12 месяцам.
Рисунок. На УЗИ пищеводно-желудочное соединение младенца: в норме вне акта глотания НСП сомкнут (2), при ГЭР определяется заброс молока из желудка в пищевод — гиперэхогенная колонна (3). До 4-х месяцев жизни ГЭР после кормления считают нормой.
При гастроэзофагальной рефлюксной болезни заброс из желудка в пищевод происходит из-за слабости сфинктеров, при повышении внутрибрюшного давления и грыже пищеводного отверстия. При ГЭРБ частому кислому рефлюксу всегда сопутствует рефлюкс-эзофагит. При тяжелом рефлюксе на УЗИ определяется более 2-х забросов за 5 минут, длительность эпизода превышает 9,5 секунд. К УЗИ-признакам эзофагита относят утолщение стенки >5 мм, расширенный просвет пищевода.
Халазия пищевода и халазия кардии на УЗИ
Халазия пищевода — ослабление перистальтики пищевода делает невозможным глотать плотную пищу, при полном отсутствии каких-либо препятствий в пищеводе. К ослаблению перистальтики чаще всего приводит эзофагит, реже инфекции, ботулизм, отравление свинцом, органические поражения ЦНС. Пища передвигается под действием силы тяжести, в пищеводе застойное содержимое.
Халазия кардии — ослабление НСП, просвет дистального отдела пищевода зияет — 6-14 мм, содержимое желудка затекает в пищевод в момент глотания, сопутствует рефлюкс-эзофагит. Зияние НСП часто встречается у грудных детей и проявляется упорными срыгиваниями после еды. До 4-х недель халазия кардии у младенца физиологична.
Кардиоспазм и ахалазия кардии на УЗИ
Кардиоспазм — повышенный тонус нижней трети пищевода и нарушение расслабления НСП при глотании. Причины кардиоспазма — функциональные расстройства нервной системы, психическая травма; изредка спазм пищевода рефлекторный при язве желудка или гельминтозах.
Более выраженные изменения обусловлены повреждением нейро-мышечных сплетений нижних 2/3 пищевода — ахалазия кардии. При ахалазии кардии в дистальном отделе пищевода отсутствуют перистальтические волны, а НСП не может полностью расслабиться при глотании.
Ахалазия кардии может быть симптомом опухоли верхнего отдела желудка, высокой ваготомии с резекцией желудка, эпифренальной лейомиомы пищевода, ЯБ, субкардиального дивертикула. Идиопатическая ахалазия — это редкое медленно прогрессирующее заболевание.
Петровский Б.В. (1957) выделяет четыре стадии заболевания:
- I стадия – функциональный непостоянный спазм кардии, расширения пищевода не наблюдается;
- II стадия – стабильный спазм кардии с нерезким расширением пищевода;
- III стадия – рубцовые изменения мышечных слоев кардии с выраженным расширением пищевода;
- IV стадия – резко выраженный стеноз кардии с дилатацией пищевода и эзофагитом.
На УЗИ грудной отдел пищевода расширен, пищеводно-желудочный переход резко сужен — раскрытие не более 3-5 мм, пассаж жидкости в желудок замедлен, в просвете застойное содержимое. Мышечный слой пищевода на ранних стадиях слегка утолщен, на поздних стадиях значительно разрастается. На застойный эзофагит указывает утолщение слизистой оболочки.
Рисунок. Ребенок с жалобами на ночной кашель в течение полугода. На УЗИ НСП сомкнут, вышележащие отделы расширены до 27 мм, пассаж в желудок начался только в положении стоя после приёма 300 мл жидкости: продольный срез на уровне НСП (1), поперечный срез в средней части пищевода (2), поперечный срез пищевода позади левой доли щитовидной железы (3), рентгенография с барием (4). При ЭГДС патологии не определяется. Заключение: Ахалазия кардии.
Рисунок. Ребенок с длительным кашлем, дисфагией, потерей веса. УЗИ пищевода: на продольном срезе (1) нижняя треть значительно расширена, у пищеводно-желудочного перехода сужается в виде воронки; на поперечном срезе из надгрудинного доступа (2) грудной отдел расширен. На рентгене с барием (3) пищевод значительно расширен, в области НСП сужен подобно клюву птицы. Заключение: Ахалазия пищевода.
Рисунок. На УЗИ НСП сомкнут, вышележащие отделы значительно расширены, пассаж жидкости с задержкой, стенка пищевода утолщена за счет мышечного и слизисто-подслизистого слоев. Заключение: Эхо-картина может соответствовать ахалазии кардии, косвенные признаки эзофагита.
Грыжа пищеводного отверстия диафрагмы на УЗИ
Грыжа пищеводного отверстия диафрагмы — это пролабирование части желудка через ослабленное диафрагмальное кольцо в грудную полость. Встречается у 15% населения старше 50-ти лет. Смещение кардии приводит к ее недостаточности, ГЭРБ. Выделяют скользящие грыжи и параэзофагальные грыжи. При скользящей грыже ПЖС и дно желудка свободно попадают в грудную полость и возвращаются обратно, а при параэзофагальной грыже ПЖС остается под диафрагмой, рядом с грудным отделом пищевода пролабирует часть желудка. У детей с врожденным коротким пищеводом (грудной желудок) имеется грыжа пищеводного отверстия и большая часть желудка находится в грудной полости. Одновременно с желудком в грудной полости могут располагаться петли кишечника.
Рисунок. Классификация грыж отверстия пищевода: тип 1 — скользящая грыжа, тип 2 — фиксированная параэзофагальнаяе грыжа, тип 3 — смешанная грыжа, тип 4 — в грудную полость вместе с желудком перемещаются кишки и другие органы брюшной полости.
На УЗИ прямой признак скользящей грыжи пищеводного отверстия диафрагмы — пищевод впадает в желудок выше диафрагмы, на вдохе часть желудка выходит в грудную полость, а на выдохе возвращение обратно. В норме пищеводно-желудочное соединение на уровне отверстия диафрагмы 7-10 мм. При грыже диаметр кишечной трубки на уровне отверстия диафрагмы 17-21 мм. Диаметр пищевода 11,5-13,5 мм — существует вероятность грыжи, более 14,5 мм — вероятность грыжи очень высока, у детей первого года 10-12 мм требует пристального внимания.
Рисунок. Грыжа отверстия пищевода на УЗИ (1, 2): воронкообразное расширение дистального отдела пищевода, на уровне диафрагмы наружный диаметр более 17 мм (норма 7-10 мм), просвет 11-15 мм, брюшной отдел укорочен (норма у взрослых >2 см), угол Гиса >90° (норма < 90°). В норме (3) брюшной отдел пищевода окружает гиперэхогенная жировая подушка (стрелки), ее отсутствует может указывать на скользящую грыжу пищевода.