Введение
В настоящее время во всем мире прослеживается тенденция к увеличению числа операций на пищеводе, выполняемых как при злокачественных, так и при доброкачественных его заболеваниях миниинвазивным методом. Такой метод имеет очевидные преимущества — прежде всего снижает травматическое воздействие на переднюю брюшную и особенно грудную стенку при сохранении возможности проводить необходимые по объему хирургические манипуляции внутри каждой из полостей. При этом наиболее часто для замещения пищевода как при частичном, так и при полном его удалении используют желудок. В случае невозможности его использования, особенно при сочетанных химических ожогах пищевода и желудка, тотальное замещение пищевода осуществляют отрезком толстой кишки. Такая тактика является общепринятой в мире при использовании открытого доступа [1, 2], но лишь в одном наблюдении описана техника выполнения малоинвазивной дистальной резекции пищевода по поводу рака нижней трети пищевода с переходом на кардиальный отдел желудка [3].
Мировой опыт пластики пищевода толстой кишкой миниинвазивным методом отсутствует.
Нашей целью явилась демонстрация успешного лечения больного с протяженной ожоговой стриктурой пищевода, которому потребовалось выполнить торакоскопическую экстирпацию пищевода с одномоментной пластикой отрезком толстой кишки с формированием эзофагоколоанастомоза на шее. Все этапы операции выполнены полностью эндовидеохирургическим методом.
Больной Т.
, 54 лет, обратился в клинику 26.06.13 с жалобами на затруднение прохождения твердой и жидкой пищи по пищеводу в течение 3 мес, снижение массы тела на 15 кг. С его слов, в феврале 2013 г. случайно сделал несколько глотков уксусной кислоты. В течение 10 дней находился под наблюдением в стационаре по месту жительства.
Обследование в МКНЦ
По данным эзофагоскопии, от верхней трети пищевода его слизистая отечна, белесая, с множественными рубцами. На расстоянии 35 см от резцов выявлена циркулярная язва, покрытая фибрином, и стриктура, суживающая просвет пищевода до 0,4 см. Осмотреть дистальные отделы пищевода и желудок стандартным эндоскопом на данном этапе не удалось. Рентгенография: протяженность рубцовой стриктуры до 12 см. Она захватывает нижнюю и среднюю треть пищевода. Супрастенотически пищевод расширен до 4 см (рис. 1). Патологических изменений в желудке не выявлено.
Рис. 1. Рентгенограмма. Протяженность стриктуры (стрелки).
С целью детального осмотра желудка и подготовки больного к оперативному лечению мы выполнили 2 процедуры бужирования стриктуры. Проходимость пищи восстановлена частично. При повторной ЭГДС данных о поражении слизистой оболочки и деформации дистальных отделов пищевода и желудка не получено. После предоперационной подготовки и коррекции алиментарного статуса больной оперирован в плановом порядке 24.07.13.
Техника операции
Эндотрахеальный наркоз с раздельной интубацией бронхов. Правое легкое полностью выключали из акта вентиляции перед введением иглы Вереша. В правой плевральной полости создавали давление до 7 мм рт.ст.
Торакальный этап
Положение больного на левом боку с отведенной вверх правой рукой. После установки 4 троакаров выделили непарную вену, которую пересекли с помощью аппарата Endo GIA-30 (белая кассета) (рис. 2).
Рис. 2. Схема расположения бригады хирургов и расстановки троакаров при выполнении торакального этапа операции (положение на левом боку). Здесь и на рис. 3: Х — хирург; А — ассистент.
Пищевод циркулярно мобилизовали на уровне средней трети и взяли на держалку, за которую осуществляли тракцию. Ветви бронхиальных артерий и грудной аорты пересекали гармоническим скальпелем либо ножницами после клипирования сосудов.
Пищевод последовательно отделяли от трахеи и перикарда, легочной вены и грудного отдела аорты. Следует подчеркнуть, что в ходе мобилизации пищевода дифференцировать его стенку от окружающих тканей было крайне сложно, в этой зоне отмечалась также повышенная диффузная кровоточивость тканей из-за явлений периэзофагита.
Абдоминальный этап
Положение больного на спине с разведенными нижними конечностями. Первоначально мы планировали заместить пищевод желудком. Для мобилизации желудка и формирования желудочной трубки установили веерообразно в горизонтальной плоскости с расположением лапароскопа около пупка 6 троакаров: 5 по 10 мм, 1 диаметром 12 мм (рис. 3). С помощью печеночного ретрактора Nathanson сместили II и III сегменты печени медиальнее, открыв доступ к пищеводу.
Рис. 3. Схема расположения хирургов и расстановки троакаров при выполнении абдоминального этапа операции.
Этап формирования желудочного трансплантата
От средней трети желудка до его пилорического отдела желудочно-ободочная связка пересечена ультразвуковым скальпелем Harmonic («Ethicon Endo-Surgery», Великобритания). Правые желудочно-сальниковые сосуды сохранены на всем протяжении. Для лучшей подвижности желудочной трубки двенадцатиперстная кишка мобилизована по Кохеру. Мобилизацию начинали с рассечения заднего листка брюшины ультразвуковым скальпелем Гармоник от печеночно-двенадцатиперстной связки по краю нисходящей ветви двенадцатиперстной кишки вплоть до ее нижнего изгиба и далее забрюшинно под корнем мезоколон до связки Трейтца. Далее продолжали мобилизацию желудка по большой кривизне по направлению к селезенке. При этом пересекали у основания левую желудочно-сальниковую артерию, короткие желудочные сосуды и диафрагмально-желудочную связку. В ходе мобилизации желудка по малой кривизне для лучшей подвижности желудочной трубки пересекали правую желудочную артерию. Визуализировали, клипировали и пересекали левые желудочные сосуды.
Изоперистальтическая желудочная трубка выкроена полностью интракорпорально с помощью линейных сшивающих степлеров Endo GIA-45 и 60. Аппаратные швы погружены на всем протяжении серо-серозным непрерывным швом (пролен 3/0).
Шейный этап
Окончив этап формирования желудочной трубки, переходили к шейному доступу. Выделенный пищевод пересекли аппаратом Endo GIA-45 (синяя кассета). Препарат, включающий внутригрудную часть пищевода и малую кривизну желудка, был удален через дополнительный лапаротомный разрез длиной 4 см. При выведении желудочной трубки на шею оказалось, что ее длина недостаточна для формирования анастомоза на шее без натяжения и риск несостоятельности анастомоза очень высок.
В такой ситуации принято решение отказаться от пластики пищевода желудком и использовать для замещения пищевода толстую кишку.
Этап формирования толстокишечного трансплантата
Для формирования трансплантата использовали левую половину толстой кишки как наиболее простой вариант в техническом отношении. Необходимую длину трансплантата определяли с помощью нити. Для этого один ее конец прикладывали к углу нижней челюсти, а другой — к пупку. Как известно, толстокишечный трансплантат такой длины используется для тотальной пластики пищевода с формированием анастомоза с глоткой. Мы сознательно формировали трансплантат несколько большей длины, чем это необходимо, чтобы не столкнуться с таким осложнением, как недостаточная длина трансплантата.
Нить перемещали в брюшную полость. Один ее конец укладывали на корень брыжейки, располагали нить по ходу a. colica media, затем — по передней поверхности поперечной ободочной и сигмовидной кишок. Место расположения дистального конца нити маркировали, намечая дистальный уровень резекции толстой кишки. Кровоснабжение толстокишечного трансплантата сохраняли за счет a. colica media, располагая его в антиперистальтической позиции. Для проверки надежности кровоснабжения трансплантата с помощью сосудистых зажимов пережимали a. colica sinistra и аркаду к этой артерии, отходящей от верхней сигмовидной артерии. Убедившись в надежности кровоснабжения трансплантата, клипировали и пересекли a. colica sinistra и кишку, с помощью сшивающих аппаратов Endo GIA в ранее намеченных местах (рис. 4).
Рис. 4. Места пересечения толстой кишки (схема).
После завершения формирования трансплантата из толстой кишки накладывали межкишечный и желудочно-толстокишечный анастомозы. Через разрез на шее, трансмедиастинально, в брюшную полость проводили зонд, к которому фиксировали апикальный конец трансплантата, его выводили на шею и формировали эзофагоколоанастомоз отдельными узловыми швами конец в бок (рис. 5).
Рис. 5. Сформированный толстокишечный трансплантат (схема).
Рану на шее, плевральную и брюшную полость дренировали.
Причины патологии
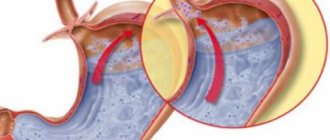
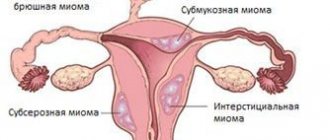
Варикозное расширение вен пищевода формируется в результате нарушения притока крови к печени по воротной вене, как правило, в результате рубцовых изменений в ткани органа. Когда отток крови по воротной вене нарушается, и в ней повышается давление, кровь начинает «искать» обходные пути. Один из них — портокавальный анастомоз (сообщение между полой и воротной веной) — находится в венах пищевода. В них тоже повышается давление, и они расширяются. При определенных условиях они могут начать кровоточить.
Наиболее распространенные причины повышения давления в воротной вене, которые приводят к варикозному расширению вен пищевода:
- Цирроз — состояние, при котором нормальная ткань печени замещается фиброзной соединительной тканью. Оно развивается в результате вирусных гепатитов, алкогольной болезни печени, жирового гепатоза, нарушения оттока желчи (первичный билиарный цирроз) и других патологических процессов.
- Хронический гепатит.
- Тромбоз — сгусток крови в воротной вене или селезеночной вене.
- Паразитарные инфекции, такие как шистосомоз.
- Сдавление воротной вены патологическими образованиями извне.
- Рак печени — гепатоцеллюлярная карцинома.
- Патологии трехстворчатого клапана сердца.
По данным проспективных исследований, у 90% пациентов с циррозом печени рано или поздно возникает расширение вен пищевода, у 30% развивается кровотечение. После того как у пациента диагностирован цирроз, вероятность возникновения варикозного расширения вен пищевода составит 5% ежегодно. Риск кровотечения составляет 10–15% в год. На момент диагностики цирроза приблизительно у 30% больных выявляется расширение венозных сосудов пищевода.
Риск развития кровотечения зависит от некоторых факторов:
- Давление в воротной вене. Чем оно выше, тем с большей вероятностью разовьется кровотечение.
- Степень расширения вен пищевода.
- Наличие «Красных маркеров»: если во время эндоскопического исследования в области варикозно расширенных вен пищевода обнаружены красные полосы или пятна, риск кровотечения выше.
- Степень нарушения функции печени. Ее оценивают по специальной шкале Чайлд-Пью. Чем более выражена печеночная недостаточность, тем выше вероятность кровотечения.
- Употребление алкоголя. Если у человека уже обнаружены варикозно расширенные вены пищевода, но он продолжает употреблять алкоголь, у него с более высокой вероятностью разовьется кровотечение.
- Если у пациента уже было кровотечение, то в будущем сохраняется риск его возникновения повторно.
Кровотечение из варикозно расширенных вен пищевода грозит серьезной кровопотерей, развитием шока и гибелью пациента. Лигирование помогает предотвратить это опасное осложнение.
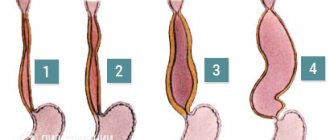
Степень варикозного расширения вен пищевода оценивают во время эндоскопического исследования. Классификация Всемирной гастроэнтерологической организации:
- 1 степень (маленький размер варикозного узла): менее 0,5 см, небольшие расширенные вены, которые видны над поверхностью слизистой оболочки.
- 2 степень (узел среднего размера): извитые расширенные вены занимают менее трети просвета пищевода.
- 3 степень (большие варикозные узлы): более 0,5 см, охватывают более трети просвета органа.
Наши врачи вам помогут
Оставьте свой номер телефона
Результаты
Операция успешно закончена полностью тораколапароскопическим методом. Кровопотеря была минимальной на всех ее этапах и составила 100 мл. Интра- и послеоперационной гемотрансфузии не требовалось. Продолжительность операции составила 660 мин. Через 4 ч от момента окончания операции больной экстубирован в отделении реанимации и интенсивной терапии, где находился в течение 6 сут. После стабилизации состояния был переведен в хирургическое отделение. Рентгенологическое исследование на 7-е сутки с водорастворимым контрастным веществом: каких-либо затеков за пределы анастомозов нет.
Дренажи из брюшной полости удалены на 2-е сутки, а из плевральной — на 3-и сутки.
К 9-м суткам у больного отмечен подъем температуры, в лабораторных показателях выявлено увеличение содержания лейкоцитов до 12,2·109/л. На 11-е сутки после операции рентгенологически у больного диагностирована микронесостоятельность эзофагоколоанастомоза. Рана на шее частично разведена. Выполнена установка зонда в толстокишечный трансплантат с целью проведения питания. Успешная консервативная терапия позволила выписать больного через 13 сут в удовлетворительном состоянии.
Плановое обследование в клинике проведено через 6 мес.
Состояние больного удовлетворительное. Жалоб на дисфагию нет. Пациент прибавил в массе 7 кг. Рентгенография: функция искусственного пищевода удовлетворительная (рис. 6).
Рис. 6. Рентгенограмма искусственного пищевода (стрелка) через 6 мес.