Колонизация Helicobacter pylori поверхности и складок слизистой оболочки желудка значительно затрудняет антибактериальную терапию. Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной.
Эрадикационная терапия Helicobacter pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, — замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы.
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала эффективность в различных клинических исследованиях. Хотя in vitro ИПП и оказывают прямой антибактериальный эффект на H. pylori, тем не менее они не играют важной роли в эрадикации инфекции.
Механизм синергии ИПП при сочетании с противомикробными препаратами, который повышает клиническую эффективность эрадикационной терапии, полностью не установлен. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов.
Хеликобактерная инфекция у детей: проблема, анализ обобщенных данных
Хронические воспалительные заболевания верхних отделов пищеварительного тракта чрезвычайно распространены в современном мире. По данным крупномасштабных эпидемиологических исследований за последнее десятилетие их показатель вырос на 37% и колеблется от 100 до 550 на 1000 детей [20]. В детской популяции в структуре этих заболеваний хронический гастродуоденит имеет стабильно высокий уровень — в пределах от 153 до 235‰.
Анализ клинико-анамнестических данных больных, проживающих на территории Московской области, позволил выявить кардинальные особенности клинической симптоматики хронического гастродуоденита у детей [20]. К ним относились: преобладание тяжелых вариантов болезни с частыми, затяжными обострениями и выраженной сезонной зависимостью их возникновения, с отчетливым нарастанием распространенности заболевания у девочек, в раннем и дошкольном возрасте.
Используемая современная методология количественной оценки факторов риска (относительный, атрибутивный риск) дала возможность авторам доказать, что хронический гастродуоденит развивается под влиянием комплекса экопатологических, биологических и социальных факторов, что подтверждает актуальность разработки специальной программы медико-экологической реабилитации [20].
Несмотря на интенсивный научный поиск и значительный прогресс в области эпидемиологии, морфологии, иммунологии, микробиологии и других специальностей, единая патогенетическая концепция гастродуоденита не разработана. Однако проясняется патофизиологическая сложность заболевания. Не вызывает сомнения, что факт признания Нelicobacter pylori этиологическим агентом большинства гастродуоденальных заболеваний и разработка эффективных схем антибактериального уничтожения возбудителя является важнейшим достижением в современной клинической гастроэнтерологии. Практический опыт подтвердил, что морфологические изменения, возникающие в слизистой оболочке гастродуоденальной зоны, подвергаются обратному развитию в случае своевременно проведенной эрадикации Н. pylori [1, 2, 9].
Наиболее убедительно доказана роль Н. pylori в этиологии язвенной болезни желудка и двенадцатиперстной кишки. Риск ее развития в течение жизни у инфицированных людей варьирует от 3% в США до 25% в Японии [4]. Эрадикация H. pylori — это утвержденный способ первоначальной терапии язвенной болезни желудка и двенадцатиперстной кишки. Более того, в проспективном продолжительном исследовании, включающем около 400 пациентов с язвенными кровотечениями, было установлено, что их рецидивы после эрадикации H. pylori не развиваются. Если эрадикация была эффективной, то назначение поддерживающей антисекреторной терапии не является обязательным [18].
На основании недавно полученных данных считают, что хеликобактерная инфекция повышает риск развития рака желудка [5, 6]. Кроме того, хеликобактерная инфекция повышает риск развития MALT лимфомы желудка. Эрадикационная терапия в настоящее время является стандартным подходом к лечению больных с I стадией опухоли и вызывает ремиссию примерно у 70% больных [5].
Накапливаются данные, демонстрирующие ассоциацию между хеликобактерной инфекцией и идиопатической тромбоцитопенией. Частота хеликобактериоза у больных с идиопатической тромбоцитопенией составляет 58%. Проведенное метааналитическое сравнение, включающее 16 исследований с проспективным когортным дизайном и одно рандомизированное исследование, показало строгую корреляцию между эрадикацией H. pylori и увеличением числа тромбоцитов [17]. Эрадикационная терапия позволяет добиться полного или частичного восстановления числа тромбоцитов примерно в половине случаев. Причиной этого факта может быть сходство антигенов тромбоцитов и H. pylori. Нельзя исключить, что H. pylori-инфекция может способствовать развитию железодефицитной и мегалобластной анемии. Недавно в клиническом исследовании было продемонстрировано нарушение всасывания железа у инфицированных пациентов и его восстановление после эрадикации микроорганизма [7].
Многие детали процесса колонизации слизистой оболочки Н. pylori до конца не изучены, однако механизмы его схематично можно представить следующим образом: хемотаксис по направлению к слизистой оболочке желудка — проникновение бактерии в слизь — адгезия к рецепторам слизи и слоям, связанным с ней, — адгезия к эпителиальным клеткам — размножение ассоциированных со слизистой оболочкой бактерий.
Н. pylori, длительно персистируя в слизистой оболочке желудка, вызывает ряд патохимических изменений и постоянную антигенную стимуляцию. Антигенспецифические и антигеннеспецифические реакции иммунной системы при инфицировании Н. рylori могут контролировать развитие инфекции, но могут также быть причастны к развитию повреждения слизистой оболочки желудка. В этой ситуации происходит реорганизация цитоскелета эпителиоцитов и ряд других изменений: эпителиальные клетки отвечают на это продукцией цитокинов — интерлейкина-8 и некоторых других хемокинов. Эти цитокины также приводят к миграции лейкоцитов из кровеносных сосудов, развивается активная стадия воспаления. Активированные макрофаги секретируют гамма-интерферон и фактор некроза опухоли. Последние сенситизируют рецепторы лимфоидных, эпителиальных и эндотелиальных клеток, что в свою очередь привлекает в слизистую оболочку новую волну клеток, участвующих в иммунных и воспалительных реакциях. Каталаза и супероксиддисмутаза, продуцируемые Н. рylori, нейтрализуют фагоциты, позволяют микробу избежать фагоцитоза и способствуют гибели полиморфноядерных лейкоцитов. Метаболиты активного кислорода нейтрофилов оказывают повреждающее действие на эпителиоциты желудка. Создаваемый порочный круг влияет на структуру эпителия и формирует хронический патологический процесс в слизистой оболочке, что в дальнейшем приводит к нарушению нормальной физиологической регенерации железистого эпителия. Доказано, что микроорганизм обусловливает дисрегенераторные процессы: влияет на пролиферацию и на апоптоз эпителиоцитов слизистой оболочки желудка. По современным представлениям, классический антрум-гастрит с мононуклеарной инфильтрацией собственной пластинки слизистой оболочки желудка является следствием взаимодействия грамотрицательных бактерий с организмом хозяина. На сегодняшний день утверждается точка зрения, согласно которой характер воспалительного ответа, его интенсивность и опосредованные им отдаленные эффекты (атрофия, гипохлоргидрия, развитие дистального рака желудка) определяются генотипом хозяина. Установлено, что худший прогноз можно ожидать у гомозигот IL-1В-31 Т/Т.
Рассматривая механизмы развития патофизиологических реакций при возникновении ассоциированных с Н. рylori заболеваний, необходимо оценить роль и место пилорического хеликобактера в целостной симбионтной эндоэкосистеме организма. На безусловную значимость состояния микробной экологии пищеварительного тракта для колонизации желудка Н. рylori и развития связанного с этими бактериями патологического процесса указывают наблюдения японских исследователей, показавших, что оральное инфицирование безмикробных крыс Н. рylori никогда не сопровождалось колонизацией слизистой оболочки желудка животных и возникновением у них гистологических изменений. Демонстративными являются собственные данные (2001), согласно которым в изучаемом микробиотопе — толстой кишке отмечалось снижение и изменение свойств индигенной микрофлоры, модификация общей микробной обсемененности и появление условно-патогенных микроорганизмов, несвойственных данному биотопу, сдвиг микробных сообществ в сторону ассоциативного роста грамотрицательных бактерий (являющихся более стойкими к антибактериальному действию окружающей среды и проявляющих более выраженную, по сравнению с грамположительными, склонность к паразитизму). В микробиоте толстой кишки частота низких титров бифидобактерий (71,4%) преобладала над показателями численности популяции лактобактерий (55,2%), больше высевалось клебсиелл и грибов рода Candida. Полученные результаты нарушения микробной колонизации исследуемого микробиотопа дали нам основание отнести дисбактериоз к биомаркерам снижения общей колонизационной резистентности пищеварительного тракта.
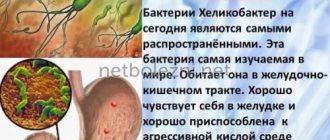
Хеликобактериоз является наиболее распространенной хронической бактериальной инфекцией у человека и имеет как этнографическую (характеризующую расу), так и социально-экономическую детерминацию. На сегодняшний день доказано, что инфицирование Н. pylori в различных регионах России имеет весьма широкий диапазон вариации и составляет от 72% до 95%. Результаты современных эпидемиологических исследований в Сибири свидетельствуют о том, что заражение Н. pylori начинается в раннем детском возрасте, достигая 33,3% к 10 годам и 56,3% — к 17-летнему возрасту, что полностью согласуется с данными, полученными в других территориях России и странах ближнего зарубежья: в Санкт-Петербурге 48% обследованных в возрасте 15–19 лет были инфицированы, в Эстонии 60% детей в возрасте 15 лет оказались серопозитивными. Обращает на себя внимание и тот факт, что частота выявления Н. pylori среди российских подростков существенно выше, чем в развитых странах. Например, доля серопозитивных детей в возрасте 10–15 лет варьировалась от 6,6% в Новой Зеландии, 11% в Великобритании, 13,4% в Италии, 16,1% в Швеции, до 17,9% в США. Что касается развивающихся стран, то инфекция Н. pylori встречается в Албании у 96%, Индии — 84%, Китае — 67%, Чехии — 63%, Мексике — 55,3% подростков. Используемая современная методология комплексной оценки факторов риска дала возможность определить ассоциацию Н. pylori с социально-экономическими условиями, прежде всего — с проживанием в неблагоустроенном жилье, низким уровнем образования и физическим трудом родителей, низким качеством питания. Безусловно, для повседневной практики важен установленный факт, что основным источником заражения служат непосредственные контакты детей с инфицированными лицами, и, как свидетельствуют исследования, проведенные в последние годы, этим источником обычно являются члены семей.
Есть данные о том, что заражение детей происходит от своих родителей. С помощью серологических исследований Н. pylori, проведенных среди населения Туркменистана (2003), установлено, что сразу после рождения у значительной части детей (49%) имелись антитела к Н. pylori, к году — их доля снижалась почти в 2 раза (26%), а затем постепенно увеличивалась в каждой возрастной группе: к 5 годам — 46%, к 10 годам — 53%, к 14 — 82%.
При изучении распространенности Н. pylori-ассоциированных болезней в детском возрасте установлена зависимость инфицирования от давности хронического гастрита, например, у больных с кратким анамнезом заболевания Н. pylori выявляется в 15% случаев, тогда как при продолжительности болезни более 5 лет возбудитель обнаруживается в 70%. Исследования, проведенные в Китае, США, Финляндии, показали, что ежегодное увеличение заболеваемости Н. pylori-ассоциированных гастритов составляет приблизительно 1%.
Поперечные клинико-эпидемиологические исследования, проведенные в России на территориях с разным уровнем антропогенного загрязнения, также подтверждают высокую распространенность Н. pylori-позитивного хронического антрального гастрита у детей, однако этот показатель чрезвычайно разнообразен и составляет от 53% до 90%.
Многочисленные публикации свидетельствуют о том, что инфекция Н. pylori является причиной всех наиболее тяжелых форм гастродуоденальной патологии у детей. Наиболее часто Н. pylori обнаруживается при эрозивном (86%) и гипертрофическом (82%) гастритах, несколько реже при других формах гастрита: субатрофическом (60%), атрофическом (58%) и поверхностном (49%). При язвенной болезни двенадцатиперстной кишки Н. pylori выделяют чаще (91–100%), чем при язвенной болезни желудка (70–100%).
Таким образом, инфекция Н. pylori имеет глобальное значение и широко распространена среди детской популяции во всем мире. Большинство исследователей соглашается с тем, что Н. pylori-инфекция обычно приобретается в детском возрасте.
Существенный прогресс был достигнут в разработках схем лечения инфекции Н. рylori, ряд из которых является общепризнанным и рекомендуется на национальном и европейском уровнях. При назначении терапии мы руководствуемся международными рекомендациями по лечению Н. pylori-ассоциированной гастродуоденальной патологии (Маастрихт-3, 2006), согласно которым общий курс лечения должен быть увеличен до 10 или 14 дней. Тем не менее, применение 7-дневных схем возможно и показано при доказанной их эффективности в конкретном регионе. В Московской области в течение последних 15 лет антихеликобактерная тройная семидневная терапия (Де-Нол + Амоксициллин + Фуразолидон), имеющая 86% эффективности, остается одной из наиболее широко использующихся в практике врача-педиатра.
Как было указано выше, инфекция Н. рylori, воздействуя на организм, приводит к нарушению баланса микрофлоры толстой кишки, который усугубляется после перорального приема антибиотиков. Полученные к настоящему моменту данные свидетельствуют о том, что после антихеликобактерной терапии у всех больных наблюдается нарушение микробиоценоза кишечника, а клинические признаки дисбактериоза выявляются у 45,5% больных. Так, по нашим данным, при исследовании кала на дисбактериоз у больных с Н. pylori-ассоциированным гастритом, получающих комбинированную терапию, отмечался дефицит нормальной микрофлоры толстой кишки, сочетающийся с ростом условно-патогенных микроорганизмов, в том числе грибов рода Candida [19]. Последнее исследование, проведенное Е. В. Каннер [3], подтвердило положение о том, что обострение хронического гастродуоденита, ассоциированного с Н. pylori-инфекцией, сопровождается грубыми нарушениями в составе нормофлоры толстой кишки у детей. При изучении метаболитного статуса копрофильтратов установлено снижение относительного содержания уксусной кислоты, повышение доли пропионовой и масляной, изменение анаэробных индексов и отношений изомеров кислот к отношению неразветвленных кислот. Было установлено, что проведение стандартной антихеликобактерной терапии усугубляет микроэкологический дисбаланс в кишечнике у 57,1% больных. Очень важный практический аспект работы касается целесообразности профилактического назначения пре- и пробиотиков, энтеросорбентов с доказанным цитомукопротективным эффектом с первых дней начала эрадикационной антихеликобактерной терапии, что снижает риск развития антибиотико-ассоциированной диареи в 10 раз [3].
Многие вопросы относительно того, нужно ли детям назначать пробиотики на фоне антибиотикотерапии, остаются без ответа. Результаты проведенного метаанализа свидетельствуют об умеренных преимуществах приема отдельного пробиотического штамма, например, Saccharomyces boulardii, или Lactobacillus GG, или комбинации пробиотиков (например, Bifidobaterium lactis и Streptococcus thermophilus) для профилактики антибиотико-ассоциированной диареи [10, 11, 12]. В настоящее время нет объективных данных об эффективности назначения других пробиотических штаммов детям.
Saccharomyces boulardii — непатогенные пробиотические дрожжевые грибы, изначально изолированные из плодов личи, произрастающего в Индонезии, и впервые примененные для лечения диареи во Франции в начале 1950 гг. Лиофилизированная форма находит широкое клиническое применение в Европе, Азии, Африке, Центральной и Южной Америке. Доклинические и экспериментальные исследования продемонстрировали противовоспалительную, антибактериальную, ферментативную, метаболическую и антитоксическую активность препарата. Saccharomyces boulardii обладают естественной резистентностью к антибиотикам и кислотности желудочного сока, что очень важно. Эффективность Saccharomyces boulardii обусловлена прямым блокирующим действием на рост патогенных штаммов. Секретируя протеазу (54 кДа), пробиотик нейтрализует определенные бактериальные токсины, другие ферментные действия осуществляются выделением полиаминов, в результате чего увеличивается количество дисахаридов (лактазы, сахарозы, мальтазы, аминопептидазы), вырабатываемых щеточной каемкой микроворсинок. Увеличение секреции полиаминов стимулирует созревание энтероцитов и способствует достижению максимальной абсорбции глюкозы на их мембраны. В недавнем рандомизированном двойном слепом плацебо-контролируемом исследовании была показана эффективность Saccharomyces boulardii у детей с острым гастроэнтеритом и взаимосвязь пробиотика с иммунным ответом организма [12]. Значительное достоверное увеличение уровня CD8 в группе детей, получавших Saccharomyces boulardii, свидетельствует о провоспалительной активности пробиотика, приводящей к высвобождению цитокинов и активации CD8 клеток, что, по-видимому, помогает ограничить инфекционный процесс. Это исследование согласуется с результатами других авторов, согласно данным которых выявлено незначительное повышение TGF-бета и снижение TNF-альфа (по механизму обратной отрицательной связи провоспалительные цитокины, стимулированные CD8, влияют на уровень TNF-альфа). Иммунологические изменения обнаружены в отношении сывороточного IgA и СРБ (С-реактивный белок). Значительное достоверное повышение уровня первого показателя и снижение второго по сравнению с исходными значениями также подтверждает важную способность пробиотика уменьшать воспалительный процесс.
Согласно опубликованным данным, Saccharomyces boulardii эффективен в качестве профилактического и лечебного средства при диарее, вызванной приемом антибиотиков, Clostridium difficile, хронической диарее, обусловленной лямблиозом, амебиазом, «диарее путешественников», у пациентов с диареей, находящихся на парентеральном питании, с ВИЧ-инфекцией. Однако основным показанием к использованию препарата является острая диарея у детей и взрослых. Много сообщений ясно показывают, что пробиотик Saccharomyces boulardii снижает продолжительность диареи (нормализация консистенции и частоты стула) и время пребывания больного в стационаре примерно на 24 часа [13, 14, 15, 16].
Многосторонний механизм действия и эффективность применения Энтерола® 250 по отношению к Бифидумбактерину в комплексной терапии хеликобактер-ассоциированных гастродуоденитов у детей были продемонстрированы в нашем исследовании [19]. Больные были рандомизированы на 2 группы: 1 группа (n = 23) — получала схему Де-Нол (240 мг), Флемоксин Солютаб (1000 мг), Фуразолидон 200 мг, Энтерол® 250 мг 2 раза в день 7 дней и далее Де-Нол 2 недели и Энтерол® 3 недели: 2 группа (n = 36) — Фуразолидона 7 дней, далее Де-Нол и коммерческие штаммы Бифидумбактерина 10 доз 3 раза в день 4 недели. Непосредственные результаты лечения оценивались по совокупности клинических, лабораторных и инструментальных данных. Лечение оказалось успешным в первой группе детей, применение Энтерола® существенным образом сказалось на быстрой стабилизации состояния больных и исчезновении гастроинтестинальных проявлений дисбактериоза. Отчетливый элиминационный эффект пробиотика получен в отношении клебсиелл, цитробактера, гемолизирующих штаммов эшерихий, грибов рода Candida, что сопровождалось в свою очередь нормализацией количественного содержания бифидобактерий, лактобацилл, кишечной палочки и энтерококков. Отмечалась хорошая динамика в копрограммах: снижалось количество непереваренных мышечных волокон, растительной клетчатки и зерен крахмала, ликвидировалась йодофильная флора. Были получены следующие доказательства преимущества комплексной терапии с Энтеролом® 250. Данный пробиотик, назначенный больному с первого дня приема антихеликобактерных средств, позволяет «защитить» индигенную микрофлору, снизить риск развития более тяжелых дисбактериозов, провоцируемых ятрогенным вмешательством используемых антимикробных препаратов, и существенно влиять на эффективность тройной терапии с базисным препаратом висмута (показатель эрадикации по протоколу составил в 1 группе — 91,3%, соответственно во 2 группе — 83,3%).
Таким образом, высокая терапевтическая эффективность, превосходные фармакологические свойства, возможность использования вместе с другими лекарствами, высокий профиль безопасности, удобный режим приема делают Энтерол® препаратом выбора для профилактики и коррекции дисбиотических нарушений, ухудшающих течение гастроэнтерологических заболеваний у детей.
В заключение хотелось бы представить разработанную нами многоуровневую программу лечения детей с Н. pylori-ассоциированными заболеваниями. Первый уровень — тщательный анализ клинической симптоматики обострения хронической гастродуоденальной патологии. Второй уровень — первичная диагностика Н. pylori-инфекции: фиброгастродуоденоскопия (ФГДС) + биопсия (уреазный «хелпил-тест» + гистологическое исследование). Мероприятия третьего уровня (7 дней) — эрадикация Н. pylori-инфекции: Де-Нол + Амоксициллин + Фуразолидон + Энтерол®. Мероприятия четвертого уровня (3–5 недель) — восстановление морфофункционального состояния слизистой оболочки желудка и двенадцатиперстной кишки с помощью Де-Нола.
По вопросам литературы обращайтесь в редакцию.
Н. И. Урсова, доктор медицинских наук, профессор
МОНИКИ им. М. Ф. Владимирского, Москва
Препараты висмута
Висмут стал одним из первых препаратов для эрадикации H. pylori. Существуют доказательства, что висмут оказывает непосредственное бактерицидное действие, хотя его минимальная ингибирующая концентрация (МИК — наименьшее количество препарата, ингибирующее рост возбудителя) в отношении H. pylori слишком высока. Как и другие тяжелые металлы, такие как цинк и никель, соединения висмута снижают активность фермента уреазы, который принимает участие в жизненном цикле H. pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий и нарушая ее целостность.
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол — это пролекарство, которое в процессе метаболизма проходит активацию бактериальной нитроредуктазой. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
NB! Результат лечения считается положительным, если результаты теста на H. pylori, проведенного не ранее 4 недель после курса лечения, будут отрицательными. Проведение теста до истечения 4 недель после эрадикационной терапии значительно повышает риск ложноотрицательных результатов. Предпочтительна отмена приема ИПП за две недели до диагностики.
Эрадикационная терапия хеликобактер пилори: схема
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной эрадикационной терапии хеликобактер пилори с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика.
В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori. Нет никаких доказательств того, что увеличение дозы кларитромицина позволит преодолеть проблему антибиотикорезистентности к препарату.
Показания к эрадикационной терапии
В соответствии с принципами, утвержденными в Маастрихте в 2000 году (the Maastricht 2–2000 Consensus Report), эрадикация H. pylori настоятельно рекомендуется:
- всем больным с язвенной болезнью;
- пациентам с низкодифференцированной MALT-лимфомой;
- лицам с атрофическим гастритом;
- после резекции по поводу рака желудка;
- родственникам больных раком желудка первой степени родства.
Необходимость проведения эрадикационной терапии пациентам с функциональной диспепсией, ГЭРБ, а также лицам, длительно принимающим нестероидные противовоспалительные препараты, пока остается предметом дискуссий. Доказательств того, что эрадикация H. pylori у подобных больных влияет на течение заболевания, нет. Однако хорошо известно, что у лиц с H. pylori, страдающих неязвенной диспепсией и корпус-преобладающим гастритом, повышается риск развития аденокарциномы желудка. Таким образом, эрадикацию H. pylori следует рекомендовать также и пациентам с неязвенной диспепсией, особенно если в гистологии выявляется корпус-преобладающий гастрит.
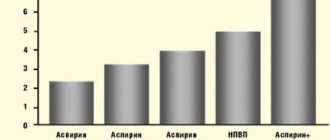
Аргумент против антихеликобактерной терапии у пациентов, принимающих НПВП, таков: организм защищает слизистую оболочку желудка от повреждающего действия лекарственных препаратов, повышая активность циклооксигеназы и синтез простагландина, а ИПП снижают естественную защиту. Тем не менее ликвидация H. pylori до назначения НПВП достоверно снижает риск язвенной болезни на фоне последующего лечения (исследование американских ученых под руководством Франсиса Чана (Francis K. Chan), опубликованное в The Lancet в 1997 году).
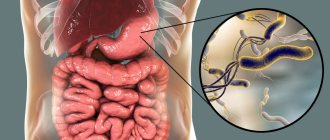
Хеликобактерная инфекция (Helicobacter pylori)
Helicobacter Pilory (Хеликобактер пилори) — бактерия, которая может жить длительное время, иногда в течении всей жизни человека, в слизистой оболочке желудка и двенадцатиперстной кишки и вызывать ее воспаление. На фоне этого воспаления снижается «устойчивость» оболочки желудочно-кишечного тракта к агрессивным факторам внутренней среды. Распространяясь с течением времени из антрального отдела в тело желудка, инфекция приводит к развитию пангастрита, который по мере прогрессирования заболевания может привести к атрофии слизистой, кишечной метаплазии и раку желудка.
Основные симптомы
Присутствие Хеликобактер пилори в организме человека часто не проявляется в виде каких-либо симптомов, пока у него не разовьется гастрит или язва желудка или двенадцатиперстной кишки.
Симптомы активного гастрита, вызванного инфекцией Helicobacter Pilory
- голодные боли в эпигастрии;
- повышенный аппетит
- изжога, отрыжка кислым;
- тошнота, рвота, приносящая облегчение
- склонность к запорам.
Механизм развития заболеваний, вызываемых бактерией H.pilory
Важным механизмом, защищающим H. pylori от воздействия агрессивной среды желудочного сока, является способность продуцировать агрессивно влияющие на слизистую ферменты (уреазу) и токсины. Эти ферменты способствуют понижению кислотности желудочного сока, а также повреждают защитный слизистый слой желудка, оголяют поверхностные клетки слизистой (эпителиоциты), делая их уязвимыми для соляной кислоты и пепсина. Колонизировав слизистую оболочку желудка, H. pylori вызывает ее воспаление, язвы, атрофию. Согласно современным представлениям атрофия слизистой оболочки желудка – это уменьшение количества желез, характерных для слизистой оболочки данного отдела желудка, и появление в железах клеток, которые не свойственны данному отделу желудка (метаплазия).
Когда необходимо обратиться к врачу
- дискомфорт и боли в эпигастрии, под ложечкой;
- тяжесть после после еды;
- жалобы на запах изо рта;
- рецидивирующий кариес;
- изжога, отрыжка кислым;
- нарушения стула;
- тошнота или рвота.
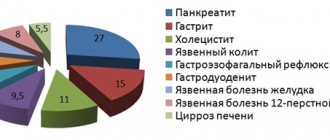
Осложнения
Заражение Хеликобактер пилори может вызывать острые и хронические заболевания: нейтрофильный острый гастрит, хронический активный гастрит, атрофический гастрит, язвенную болезнь, кишечную метаплазию эпителия желудка (замещение клеток желудка клетками кишечника), рак желудка, мальтому желудка, b-клеточную неходжкинскую лимфому желудка.
Вред, который бактерия Хеликобактер пилори нанесет желудку, зависит не только от состояния иммунной системы человека, но и от того, каким именно штаммом бактерии произошло заражение. Разные штаммы бактерии вырабатывают разный состав токсинов, повреждающих слизистую оболочку. Не у всех людей заражение этой бактерией приводит к развитию заболеваний желудка и двенадцатиперстной кишки, но если такие заболевания есть, уничтожение бактерии обеспечит заболевшим в большинстве случаев полное выздоровление.
Эрадикационная терапия
Несмотря на применение комбинированных схем лечения, у 10–20 % пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя. Наилучшей стратегией считается подбор наиболее эффективной схемы лечения, однако не следует исключать возможность использования двух и даже более последовательных схем в случае недостаточной эффективности терапии выбора.
В случае неудачной первой попытки эрадикации H. pylori рекомендуют сразу перейти к терапии второй линии. Посев на чувствительность к антибиотикам и переход на схемы терапии спасения показан только тем пациентам, у которых терапия второй линии также не приведет к эрадикации возбудителя.
Одной из самых эффективных «схем спасения» является комбинация ИПП, рифабутина и амоксициллина (или левофлоксацина по 500 мг) на протяжении 7 дней. Исследование итальянских ученых, проведенное под руководством Фабрицио Перри (Fabrizio Perri) и опубликованное в Alimentary Pharmacology & Therapeutics в 2000 году, подтвердило, что схема с рифабутином эффективна против штаммов H. pylori, резистентных к кларитромицину или метронидазолу. Однако высокая цена рифабутина ограничивает его широкое применение.
NB! Во избежание формирования резистентности одновременно к метронидазолу и кларитромицину эти препараты никогда не комбинируют в одной схеме. Эффективность подобной комбинации очень высока, однако у пациентов, не ответивших на терапию, обычно формируется устойчивость сразу к обоим препаратам (исследование немецких ученых под руководством Ульриха Пейтца (Ulrich Peitz), опубликованное в Alimentary Pharmacology & Therapeutics в 2002 году). И дальнейший подбор терапии вызывает серьезные затруднения.
Данные исследований подтверждают, что 10‑дневная схема терапии спасения, включающей рабепразол, амоксициллин и левофлоксацин, гораздо эффективнее, чем стандартная эрадикационная терапия второй линии (исследование итальянских ученых под руководством Энрико Ниста (Enrico C Nista), опубликованное в Alimentary Pharmacology & Therapeutics в 2003 году).
Helicobacter pylori (хеликобактер пилори)
Хеликобактер пилори
(лат.
Helicobacter pylori
) — спиралевидная грамотрицательная микроаэрофильная бактерия, инфицирующая слизистую оболочку желудка и двенадцатиперстной кишки. Иногда называют
геликобактер пилори
(см. Циммерман Я.С.).
Заблуждения, связанные с Helicobacter pylori
Нередко, при обнаружении Helicobacter pylori
, пациенты начинают беспокоиться об их эрадикации (уничтожении). Само наличие
Helicobacter pylori
в желудочно-кишечном тракте не является причиной для немедленной терапии с применением антибиотиков или других средств. В России количество носителей
Helicobacter pylori
достигает 70 % населения и подавляющее большинство из них не страдает какими-либо заболеваниями желудочно-кишечного тракта. Процедура эрадикации предполагает прием двух антибиотиков (например, кларитромицина и амоксициллина). У пациентов, имеющих повышенную чувствительность к антибиотикам, возможны аллергические реакции — от антибиотик-ассоциированной диареи (не тяжелое заболевание) до псевдомембранозного колита, вероятность возникновения которого мала, но процент летальных исходов большой. Кроме того, прием антибиотиков отрицательно воздействует на «дружественную» микрофлору кишечника, мочеполовых путей и способствует развитию резистентности к данному виду антибиотиков. Имеются данные, что после успешной эрадикации
Helicobacter pylori
в течение ближайших лет чаще всего наблюдается реинфекция слизистой желудка, которая уже через 3 года составляет 32±11 %, через 5 лет — 82–87%, а через 7 лет — 90,9% (Циммерман Я.С.). Пока боль не проявилась, хеликобактериоз лечить не следует. Более того, у детей до восьмилетнего возраста вообще не рекомендуется проводить эрацикационную терапию, потому что у них иммунитет еще не сформирован, антитела к
Helicobacter pylori
не вырабатываются. Если у них провести эрадикацию до 8-летнего возраста, то через день, пообщавшись кратковременно с другими детьми, «схватят» эти бактерии (П.Л. Щербаков).
Helicobacter pylori
однозначно требует эрадикации, если у больного имеется язва желудка или двенадцатиперстной кишки, МАLТома или если у него была резекция желудка по поводу рака. Многие авторитетные гастроэнтерологи (не все) в этот список включают также атрофический гастрит.
Эрадикация Helicobacter pylori
может быть рекомендована для снижения риска развития рака желудка. Известно, что как минимум 90% случаев рака желука связаны с H. pylori-инфекцией (Старостин Б.Д.).
| Helicobacter pylori от экспериментально моноинфицированных мышей (A), слизистой оболочки желудка человека (B) и культивированные на пластине агара (C). Как выделенных от экспериментально инфицированных мышей, так и при биопсии человека поверхность Helicobacter pylori является грубой, а жгутики имеют тенденцию склеиваться. За исключением коккоидной формы, морфология сравнительно хорошо сохраняется в культуре на агаре (С). Масштабные метки = 1 мкм. Источник: Stoffel M.H. et al. Distinction of Gastric Helicobacter spp. in Humans and Domestic Pets by Scanning Electron Microscopy / January 2001. DOI: 10.1046/j.1523-5378.2000.00036.x. Blackwell Science, 1083-4389/00/232–239. Inc. Volume 5 • Number 4 • 2000. |
Факторы вирулентности Helicobacter pylori
Известно несколько факторов вирулентности, позволяющих Helicobacter pylori
заселять, а затем персистировать в организме хозяина (Скворцов В.В., Скворцова Е.М.).
- Жгутики позволяют Helicobacter pylori
передвигаться в желудочном соке и слое слизи. - Helicobacter pylori
способен прикрепляться к плазмолемме эпителиальных клеток желудка и разрушать компоненты цитоскелета этих клеток. - Helicobacter pylori
вырабатывает уреазу и каталазу. Уреаза расщепляет мочевину, содержащуюся в желудочном соке, что повышает рН непосредственного окружения микроба и защищает его от бактерицидного действия кислой среды желудка. - Helicobacter pylori
способен подавлять некоторые иммунные реакции, в частности фагоцитоз. - Helicobacter pylori
вырабатывает адгезины, способствующие адгезии бактерий к эпителиальным клеткам и затрудняющие их фагоцитоз полиморфно-ядерными лейкоцитами.
Язва двенадцатиперстной кишки, ассоциированная с Helicobacter pylori
Основным местом обитания Helicobacter pylori
является слизистая оболочка антрального отдела желудка, пораженная воспалительно-атрофическим процессом — гастритом, ассоциированным с
Helicobacter pylori
. Для развития язвы двенадцатиперстной кишки, ассоциированной с
Helicobacter pylori
, необходимо наличие в слизистой оболочке двенадцатиперстной кишки участков желудочной метаплазии, которая в свою очередь связана с увеличение кислотности двенадцатиперстной кишки. Таким образом, язва двенадцатиперстной кишки, ассоциированная с
Helicobacter pylori
и дуоденит всегда развиваются на фоне кислотно-пептической агрессии в двенадцатиперсную кишку, т.е. одновременно являются и кислотно-зависимой патологией. При этом важнейшим фактором гиперсекреции соляной кислоты в желудке является прямое влияние
Helicobacter pylori
на секреторный процесс путем избыточного ощелачивания антрального отдела желудка продуктами гидролиза мочевины уреазой, вырабатываемой
Helicobacter pylori
. Следствием избыточного ощелачивания является гипергастринемия, приводящая в свою очередь к гиперпродукции соляной кислоты. Нарушения в регуляции кислотообразования при ассоциированном с
Helicobacter pylori
гастрите также обусловлены самим процессом специфического воспаления и его медиаторами (цитокинами и эпидермальными факторами роста), синтезируемыми в слизистой оболочке антрального отдела желудка в ответ на инфицирование
Helicobacter pylori
, особенно выраженное у цитотоксичных штаммов. Данные штаммы могут не только вызывать выраженное воспаление в желудке, но и способствовать развитию деструктивных процессов – язвообразованию, в том числе в двенадцатиперстной кишки в участках желудочной метаплазии. Этому способствуют агрессивные факторы дуоденальной среды, снижение защитных свойств слизистого барьера, нарушение микроциркуляции (в том числе из-за
Helicobacter pylori
), наследственная предрасположенность. Все эти процессы приводят к появлению язвы (Маев И.В, Самсонов А.А.).
Схемы эрадикации Helicobacter pylori
Всемирной организаций здравоохранения к активным препаратам в отношении Helicobacter pylori
отнесены метронидазол, тинидазол, коллоидный субцитрат висмута, кларитромицин, амоксициллин и тетрациклин (Подгорбунских Е.И., Маев И.В., Исаков В.А.). Эрадикация
Helicobacter pylori
не всегда достигает цели. Очень широкое и неправильное применение распространенных антибактериальных средств привело к повышению устойчивости к ним
Helicobacter pylori
. На рисунке справа (взято из статьи Белоусовой Ю.Б., Карпова О.И., Белоусова Д.Ю. и Бекетова А.С.) показана динамика резистентности к метронидазолу, кларитромицину и амоксициллину штаммов
Helicobacter pylori
, выделенных от взрослых (сверху) и от детей (снизу). Признано, что в разных странах мира (разных регионах) целесообразно применение разных схем. Ниже даны рекомендации по эрадикации
Helicobacter pylori
, изложенные в Стандартах диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний принятых Научным обществом гастроэнтерологов России в 2010 г. Выбор схемы эрадикации зависит от наличия индивидуальной непереносимости пациентами конкретных лекарств, а также чувствительности штаммов
Helicobacter pylori
к этим лекарствам. Применение кларитромицина в эрадикационных схемах возможно лишь в регионах, где резистентность к нему менее 15–20 %. В регионах с резистентностью выше 20 % его использование целесообразно только после определения чувствительности
Helicobacter pylori
к кларитромицину бактериологическим методом или методом полимеразной цепной реакции.
Антациды могут применяться в комплексной терапии в качестве симптоматического средства и в монотерапии — до проведения рН-метрии и диагностики Helicobacter pylori
.
Первая линии антигеликобактерной терапии
Вариант 1.
Один из ингибиторов протонной помпы (ИПП) в стандартной дозировке (омепразол 20 мг, лансопразол 30 мг, пантопразол 40 мг, эзомепразол 20 мг, рабепразол 20 мг) 2 раза в день и амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с кларитромицином (500 мг 2 раза в день), или джозамицином (1000 мг 2 раза в день), или нифурателем (400 мг 2 раза в день) в течение 10–14 дней.
Вариант 2.
Лекарства, используемые при варианте 1 (один из ИПП в стандартной дозировке, амоксициллин в сочетании с кларитромицином, или джозамицином, или нифурателем) с добавлением четвертого компонента — висмута трикалия дицитрата 120 мг 4 раза в день или 240 мг 2 раза в день в течение 10–14 дней.
Вариант 3 (при наличии атрофии слизистой оболочки желудка с ахлоргидрией, подтвержденной при рН-метрии
).
Амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с в сочетании с кларитромицином (500 мг 2 раза в день) или джозамицином (1000 мг 2 раза в день), или нифурателем (400 мг 2 раза в день), и висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 10-14 дней.
Примечание.
При сохранении язвенного дефекта по результатам контрольной эндоскопии на 10–14-й день от начала лечения рекомендовано продолжить терапию висмута трикалия дицитратом (120 мг 4 раза в день или 240 мг 2 раза в день) и/или ИПП в половинной дозе в течение 2–3 недель. Пролонгированная терапия висмута трикалия дицитратом показана также в целях улучшения качества послеязвенного рубца и скорейшей редукции воспалительного инфильтрата
Вариант 4 (рекомендуется только пожилым больным в ситуациях, при которых полноценная антигеликобактерная терапия невозможна):
а) ИПП в стандартной дозировке в сочетании с амоксициллином (500 мг 4 раза в день или 1000 мг 2 раза в день) и висмута трикалия дицитратом (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 14 дней
б) висмута трикалия дицитрат по 120 мг 4 раза в день в течение 28 дней. При наличии болей — короткий курс ИПП.
Вариант 5 (при наличии поливалентной аллергии к антибиотикам или отказе больного от антибактериальной терапии).
Один из ИПП в стандартной дозировке в сочетании с 30 %-ным водным раствором прополиса (100 мл 2 раза в день натощак) в течение 14 дней.
Вторая линия антигеликобактерной терапии
Выполняется при отсутствии эрадикации Helicobacter pylori
после терапии первой линии.
Вариант 1.
Один из ИПП в стандартной дозировке, висмута трикалия дицитрат по 120 мг 4 раза в день, метронидазол по 500 мг 3 раза в день, тетрациклин 500 мг 4 раза в день в течение 10–14 дней.
Вариант 2.
Один из ИПП в стандартной дозировке, амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) в сочетании с нитрофурановым препаратом: нифурателем (400 мг 2 раза в день) или фуразолидоном (100 мг 4 раза в день) и висмута трикалия дицитрат (120 мг 4 раза в день или 240 мг 2 раза в день) в течение 10–14 дней.
Вариант 3.
Один из ИПП в стандартной дозировке, амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день), рифаксимин (400 мг 2 раза в день), висмута трикалия дицитрат (120 мг 4 раза в день) в течение 14 дней.
Третья линия антигеликобактерной терапии
При отсутствии эрадикации Helicobacter pylori
после лечения второй линии рекомендуется подбор терапии только после определения чувствительности
Helicobacter pylori
к антибиотикам.
В последнее десятилетие разработано большое число различных схем эрадикации Helicobacter pylori. Некоторые схемы на основе висмута трикалия дицитрата имеются в статье «Де-нол».
Советуем также ознакомиться с
«Рекомендациями Британского общества гастроэнтерологов пациентам в отношении Helicobacter pylori».
Гибридная схема
По мнению некоторых исследователей, сегодня перспективной является гибридная терапия. Она включает 7-дневный курс ИПП (стандартная доза) и амоксициллина (1 г 2 раза в день) с последующим 7-дневным курсом четырехкомпонентной схемы с применением ИПП (стандартная доза), амоксициллина (1 г 2 раза в день), кларитромицина (500 мг 2 раза в день) и метронидазола (500 мг 2 раза в день) (Парцваниа-Виноградова Е.В.).
Рекомендации «Маастрихт IV» в отношении схем эрадикации H. pylori
В 1987 г. была основана Европейская группа по изучению инфекции H. pylori
— European helicobacter pylori study group (EHSG), целью которой явилось содействие междисциплинарным исследованиям патогенеза
H. pylori
-ассоциированных заболеваний. По месту проведения первой согласительной конференции все соглашения называются Маастрихтскими. Четвертая согласительная конференция прошла во Флоренции в ноябре 2010 года. Выработка Guidelines (рекомендаций) по результатам этой конференции продолжалась два года. Схемы эрадикационной терапии в соответствии с консенсусом Маастрихт IV представлены на рисунке ниже (Маев И.В. и др.):
В России отсутствуют полномасштабные исследования, устанавливающие уровень распространённости резистентнных к кларитромицину штаммов
H. pylori
. Однако имеется несколько локальных исследований, в каждом из которых установлен в терминологии Маастрихта IV низкий уровень резистентности и, исходя из этого, в российских условиях, скорее всего, более целесообразно применять левую часть схемы, обозначенную зелёным.
Статьи, методические рекомендации
- Ивашкин В.Т., Маев И.В., Лапина Т.Л. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых // РЖГГК. 2021. № 28(1). С. 55–77.
- Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А., Трухманов А.С., Абдулхаков Р.А. и др. Лечение инфекции Helicobacter pylori: мейнстрим и новации // Рос журн гастроэнтерол гепатол колопроктол. 2017. № 27(4). С. 4-21.
- Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (пятое Московское соглашение) // XIII съезд НОГР. 12 марта 2013 г.
- Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (четвертое Московское соглашение) / Методические рекомендации № 37 Департамента здравоохранения города Москвы. – М.: ЦНИИГ, 2010. – 12 с.
- Циммерман Я. С. Язвенная болезнь: критический анализ современного состояния проблемы // Экспериментальная и клиническая гастроэнтерология. — 2021. — 149(1). С. 80–89.
- Корниенко Е.А., Паролова Н.И. Антибиотикорезистентность Helicobacter pylori у детей и выбор терапии // Вопросы современной педиатрии. – 2006. – Том 5. – № 5. – с. 46–50.
- Циммерман Я.С. Проблема растущей резистентности микроорганизмов к антибактериальной терапии и перспективы эрадикации Helicobacter pylori-инфекции / В кн.: Нерешенные и спорные проблемы современной гастроэнтерологии. – М.: МЕДпресс-информ, 2013. С.147-166.
- Диагностика и лечение инфекции Helicobacter pylori – отчет согласительной конференции Маастрихт IV / Флоренция // Вестник практического врача. Спецвыпуск 1. 2012. С. 6-22.
- Исаков В.А. Диагностика и лечение инфекции, вызванной Helicobacter pylori: IV Маастрихтское соглашение / Новые рекомендации по диагностике и лечению инфекции H.Pylori – Маастрихт IV (Флоренция). Best Clinical Practice. Русское издание. 2012. Вып.2. С.4-23.
- Маев И.В., Самсонов А.А., Андреев Д.Н., Кочетов С.А., Андреев Н.Г., Дичева Д.Т. Современные аспекты диагностики и лечения инфекции Helicobacter pylori // Медицинский Совет. 2012. №8. C. 10–19.
- Ракитин Б.В. Helicobacter pylori – Маастрихт IV.
- Ракитин Б.В. Информация о согласительной конференции по диагностике и лечению инфекции Helicobacter pylori «Маастрихт V» из доклада М. Лея на 42-ой научной сессии ЦНИИГ, 2-3 марта 2021.
- Маев И.В., Рапопорт С.И., Гречушников В.Б., Самсонов А.А., Сакович Л.В., Афонин Б.В., Айвазова Р.А. Диагностическая значимость дыхательных тестов в диагностике инфекции Helicobacter pylori // Клиническая медицина. 2013. № 2. С. 29–33.
- Казюлин А.Н., Парцваниа-Виноградова Е.В., Дичева Д.Т. и др. Оптимизация антихеликобактерной терапии в современной клинической практике // Consilium medicum. – 2021. — №8. – Том 18. С. 32-36.
- Malfertheiner P, Megraud F, Morain CAO, Gisbert JP, Kuipers EJ, Axon AT, Bazzoli F, Gasbarrini A et al. Management of Helicobacter pylori infection—the Maastricht V/Florence Consensus Report // Gut 2016;0:1–25. doi:10.1136/gutjnl-2016-312288.
- Старостин Б.Д. Лечение Helicobacter руlогі-инфекции — Маастрихсткий V/Флорентийский консенсусный отчет (перевод с комментариями) // Гастроэнтерология Санкт-Петербурга. 2017; (1): 2-22.
- Маев И.В., Андреев Д.Н., Дичева Д.Т. и др. Диагностика и лечение инфекции Helicobacter pillory. Положения консенсуса Маастрихт V (2015 г.) // Архивъ внутренней медицины. Клинические рекомендации. — № 2. — 2021. С. 85-94.
- Оганезова И.А., Авалуева Е.Б. Helicobacter pylori-негативная язвенная болезнь: исторические факты и современные реалии. Фарматека. 2017; Гастроэнтерология/Гепатология:16-20.
- Маев И.В., Решетняк В.И. Helicobacter pylori и дормантность / Доказательная гастроэнтерология. 2021. Т. 9, №1, вып. 2, стр. 10-11.
- Парцваниа-Виноградова Е.В. Оценка эффективности и безопасности гибридной схемы эрадикационной терапии инфекции Helicobacter pylori у пациентов с язвенной болезнью желудка и двенадцатиперстной кишки. Автореферат дисс. к.м.н., М., 2021.
На сайте в каталоге литературы имеется раздел «Helicobacter pylori», содержащий медицинские профессиональные статьи, посвященные заболеваниям ЖКТ, ассоциированным с Helicobacter pylori.
Видео
Кадр из видео: Шурпо Е.М. Хронический гастрит (лекция для студентов медицинского университета)
Кадр из видео: Серебровская Н.Б. Кафедра педиатрии МГМСУ им. А.И. Евдокимова. Заболевания органов пищеварения у детей. Лекция для студентов
Кадр из видео: Филиппова М.П. Язвенная болезнь. Лекция для 2-го курса ФКП МГМСУ им. А.И.Евдокимова
Кадр из видео: Лебедева А.В. Кислотозависимые заболевания желудочно- кишечного тракта. Лекция для студентов ИвГМУ
Кадр из видео: Вялов С.С. Рефлюксный секрет
Кадр из видео: Бережная И.В., Камлыгина М.В. Ингибиторы протонной помпы. СИБР как осложнение
Кадр из видео: Эмбутниекс Ю.В. Аутоиммунный гастрит: принципы диагностики и лечения
Кадр из видео: Волынец Г.В. Функциональные и воспалительные заболевания верхнего отдела пищеварительного тракта у детей
На сайте в разделе «Видео» имеются подраздел для пациентов «Популярная гастроэнтерология» и подраздел «Для врачей», содержащий видеозаписи докладов, лекций, вебинаров по различным направлениям гастроэнтерологии для профессионалов здравоохранения.
Проведение эрадикации Helicobacter pylori у беременных и кормящих матерей
Эрадикация Helicobacter рylori
согласно Маастрихтским консенсусам II-2000 и III-2005 у беременных не проводится. Решение вопроса о проведении эрадикации
Helicobacter рylori
ставится после родоразрешения и окончания периода кормления грудью (Ребров Б.А., Комарова Е.Б.).
Распространённость Helicobacter pylori в разных странах и в России
По данным Всемирной гастроэнтерологической организации (Helicobacter pylori
в развивающихся странах, 2010, WGO) более половины населения Земли является носителями
Helicobacter pylori
), при этом частота инфицированности значительно варьируется между различными странами, а также внутри этих стран. В целом, инфицированность возрастает с возрастом. В развивающихся странах инфицированность
Helicobacter pylori
значительно более выражена у лиц молодого возраста, чем в развитых странах.
ВГО приводит следующие цифры:
| Страна (регион) | Возрастные группы | Частота инфицированности |
| Европа | ||
| Восточная Европа | взрослые | 70 % |
| Западная Европа | взрослые | 30-50 % |
| Албания | 16-64 | 70,7 % |
| Болгария | 1-17 | 61,7 % |
| Чехия | 5-100 | 42,1 % |
| Эстония | 25-50 | 69 % |
| Германия | 50-74 | 48,8 % |
| Исландия | 25-50 | 36 % |
| Нидерланды | 2-4 | 1,2 % |
| Сербия | 7-18 | 36,4 % |
| Швеция | 25-50 | 11 % |
| Северная Америка | ||
| Канада | 5-18 | 7,1 % |
| Канада | 50-80 | 23,1 % |
| США и Канада | взрослые | 30 % |
| Азия | ||
| Сибирь | 5 | 30 % |
| Сибирь | 15-20 | 63 % |
| Сибирь | взрослые | 85 % |
| Бангладеш | взрослые | > 90 % |
| Индия | 0-4 | 22 % |
| Индия | 10-19 | 87 % |
| Индия | взрослые | 88 % |
| Япония | взрослые | 55-70 % |
| Австралия и Океания | ||
| Австралия | взрослые | 20 % |
Причиной разной инфицированности может быть социоэкономическое различие между популяциями. Заражение Helicobacter pylori
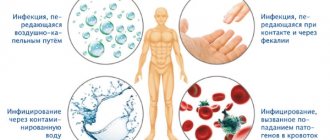
в основном происходит орально-оральным или фекально-оральным путями. Отсутствие санитарии, безопасной питьевой воды, базовых понятий о гигиене, а также ограниченная диета и большое скопление населения, могут играть роль в высокой распространенности инфекции.
Россия относится к странам с очень высокой распространенностью хеликобактерной инфекции. В некоторых регионах, например, в Восточной Сибири, эта цифра превышает 90% и в монголоидной, и в европеоидной популяции. В Москве инфицированность Helicobacter pylori
ниже. По данным ЦНИИ Гастроэнтерологии около 60% жителей ВАО Москвы – носители хеликобактера. Хотя в отдельных группах населения хеликобактер более распространен. В частности, среди работников промышленных предприятий Москвы инфицированы
Helicobacter pylori
88 % (Бордин Д.С.).
Приказом Минздравсоцразвития России №1664н от 27 декабря 2011 г. «Об утверждении номенклатуры медицинских услуг» медицинская включена в номенклатуру медицинских услуг, раздел 26.
Helicobacter pylori в систематике бактерий
Helicobacter pylori
относится к роду
Helicobacter, который входит в семейство Helicobacteraceae,
порядок
Campylobacterales
, класс Epsilonproteobacteria, подтип
delta/epsilon subdivisions
, тип
Proteobacteria
, царство Бактерии. Ранее
Helicobacter pylori
назывался
Campylobacter pyloridis
и включался в состав рода кампилобактер (
Campylobacter
).
Helicobacter pylori у животных
Кроме человека, Helicobacter pylori
колонизирует желудок у кошек и обезьян-приматов.
Helicobacter pylori в МКБ-10
Helicobacter pylori
упоминается в «Классе I. Некоторые инфекционные и паразитарные болезни (A00-B99)» Международной классификации болезней МКБ-10, бактерия включена в блок «B95-B98 Бактериальные, вирусные и другие инфекционные агенты» и имеет код рубрики «B98.0
Helicobacter pylori
[
H. pylori] как причина болезней, классифицированных в других рубриках». Данный код предназначен для использования в качестве дополнительного, когда целесообразно идентифицировать инфекционных агентов болезней, классифицированных в других рубриках. Назад в раздел